题目内容
【题目】铁的重要化合物高铁酸钾(K2FeO4)是一种新型饮用水消毒剂,具有很多优点。而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_______________________________;若维持电流强度为1A,电池工作10 min ,理论消耗Zn ___________g(已知F=96500 C/mol)。
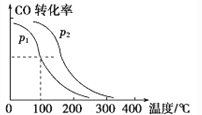
(2)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有______________________________________。
(3)高铁酸钾生产方法之二是在强碱性介质中用KClO氧化Fe(OH)3生成高铁酸钾,该反应的离子方程式为_______________________________________。
(4)K2FeO4能消毒、净水的原因________________________________________。
【答案】 FeO42- +4 H2O+3e- = Fe(OH)3+5 OH- 0.2 工作时间长工作电压稳定。 3ClO-+2Fe(OH)3+4 OH-=2 FeO42- +3Cl-+5 H2O +6价铁具有强氧化性能杀菌消毒且反应生成三价铁离子水解又生成氢氧化铁胶体吸附水中悬浮物。
【解析】试题分析:(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,左边烧杯只能生成三价铁,三价铁离子在碱溶液中沉淀下来;(2)由图可知高铁电池的优点有:使用时间长、工作电压稳定 ;(3) Fe(OH)3中Fe元素化合价由+3价升高为+6价,共升高3价,KClO中Cl元素化合价由+1价降低为-1价,共降低2价,根据化合价升降相同配平方程式;(3)+6价铁具有强氧化性,氢氧化铁胶体吸附水中悬浮物;
解析:(1)根据电池装置,Zn做负极,C为正极,高铁酸钾的氧化性很强,左边烧杯只能生成三价铁,三价铁离子在碱溶液中沉淀下来;正极上高铁酸钾发生还原反应生成Fe(OH)3,正极电极反应式为:FeO42-+4H2O+3e-═Fe(OH)3↓+5OH-;若维持电流强度为1A,电池工作十分钟,通过电子为![]() ,则理论消耗Zn为
,则理论消耗Zn为![]() 0.2g;(2)由图可知高铁电池的优点有:使用时间长、工作电压稳定;(3) Fe(OH)3中Fe元素化合价由+3价升高为+6价,共升高3价,KClO中Cl元素化合价由+1价降低为-1价,共降低2价,根据化合价升降相同配平,反应离子方程式是3ClO-+2Fe(OH)3+4 OH-=2 FeO42- +3Cl-+5 H2O;(5) K2FeO4中+6价铁具有强氧化性能杀菌消毒且反应生成三价铁离子水解又生成氢氧化铁胶体吸附水中悬浮物,所以K2FeO4能消毒、净水。
0.2g;(2)由图可知高铁电池的优点有:使用时间长、工作电压稳定;(3) Fe(OH)3中Fe元素化合价由+3价升高为+6价,共升高3价,KClO中Cl元素化合价由+1价降低为-1价,共降低2价,根据化合价升降相同配平,反应离子方程式是3ClO-+2Fe(OH)3+4 OH-=2 FeO42- +3Cl-+5 H2O;(5) K2FeO4中+6价铁具有强氧化性能杀菌消毒且反应生成三价铁离子水解又生成氢氧化铁胶体吸附水中悬浮物,所以K2FeO4能消毒、净水。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。