题目内容
【题目】硼镍镧合金具有很强的储氢能力。
(1)用价层电子对互斥理论推测三氟化硼分子的立体构型为______,硼原子的杂化类型为_____。
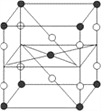
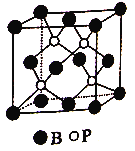
(2)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞示意图,已知该晶胞的棱长为516pm,最近的B和P原子之间的距离为____pm。该晶体的晶体类型是________。
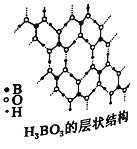
(3)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如上图)。
①1molH3BO3的晶体中有_____mol氢键。
②硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,则硼酸为_______元酸,[B(OH)4]-含有的化学键类型为_______。
(4)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构,其中铜钙合金的结构单元如图所示。试回答下列问题:
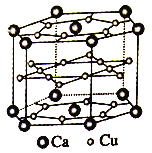
①在元素周期表中Ca位于______区。
②铜原子的基态原子核外电子排布式__________。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=_____(填数值);氢在合金中的密度为_____(保留两位有效数字)。
【答案】 平面三角形 ;sp2 223.4 pm 原子晶体 3 一 共价键、配位键 s [Ar]3d104sl 5 0.083 g/cm3
【解析】⑴ BF3中B原子形成3个δ键,孤对电子数为0.5×(3-3×1)=0, BF3中价层电子对个数=3+0.5(3-3×1)=3,且不含孤电子对,所以空间构型是平面三角形,中心原子是以sp2杂化;正确答案:平面三角形 ;sp2。
(2)根据晶胞结构图,该晶胞中含有4个P,B原子的个数为8×1/8+6×1/2=4,因此化学式为BP;根据BP的性质及用途:耐磨涂料,可用作金属的表面保护层等可判断BP为原子晶体,微粒间作用力为共价键;已知晶胞的棱长为516pm,体对角线为516√3 pm,磷原子在体对角线上,且与B原子的距离最近为体对角线的1/4,所以最近的B和P原子之间的距离为1/4×516√3 =64.5√3= 223.4pm;正确答案:原子晶体;223.4。
(3)①硼酸分子中B与三个原子形成单键,最外层有6个电子,根据图示,1个H3BO3分子与其他3个分子能形成6个氢键,因此1 mol H3BO3的晶体中氢键为6 mol×1/2=3 mol;正确答案:3。
②硼酸溶于水生成弱电解质一水合硼酸![]() ,它电离生成少量
,它电离生成少量![]() 和
和![]() 离子,则硼酸能电离出一个氢原子,所以硼酸属于一元酸
离子,则硼酸能电离出一个氢原子,所以硼酸属于一元酸![]() 含有的化学键类型为共价键、配位键;正确答案:一;共价键、配位键。
含有的化学键类型为共价键、配位键;正确答案:一;共价键、配位键。
(4)①Ca位于第四周期第ⅡA族,处于s区;正确答案:s 。
②Cu的外围电子构型是3d104s1;正确答案:[Ar]3d104sl。
③铜、钙合金中,N(Cu)=12×1/2+6×1/2+6=15。N(Ca)=12×1/6+2×1/2=3,![]() =3/15=1/5,所以n=5,即LaNi5H4.5;ρ·9.0×10-23cm3·NA=M,其中氢在合金中的密度为
=3/15=1/5,所以n=5,即LaNi5H4.5;ρ·9.0×10-23cm3·NA=M,其中氢在合金中的密度为![]() ≈0.083 g·cm-3;正确答案:5 ;0.083。
≈0.083 g·cm-3;正确答案:5 ;0.083。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
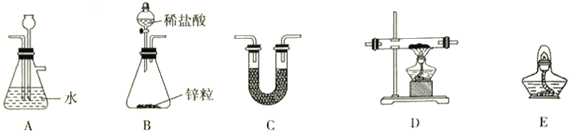
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
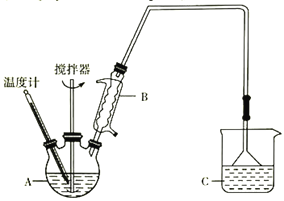
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。