题目内容
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法正确的是
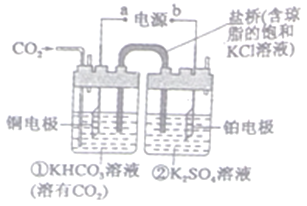
A. 该过程是化学能转化为电能的过程
B. 一段时间后,①池中n(KHCO3)不变
C. 一段时间后,②池中溶液的pH不变
D. 铜电极的电极反应式为9CO2+6H2O+8e-=CH4+8HCO3-
【答案】D
【解析】该装置是一个电解池,电解池是将电能转化为化学能的装置,A错误;在电解池的阴极上发生二氧化碳得电子的还原反应,即![]() ═
═![]() ,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以
,一段时间后,氢离子减小,氢氧根浓度增大,氢氧根会和①池中的碳酸氢钾反应,所以![]() 会减小,B错误;在电解池的阳极上,是氢氧根离子发生失电子的氧化反应,所以酸性增强,pH一定下降,C错误;
会减小,B错误;在电解池的阳极上,是氢氧根离子发生失电子的氧化反应,所以酸性增强,pH一定下降,C错误;![]() 电催化还原为
电催化还原为![]() 的过程是一个还原反应过程,所以铜电极是电解池的阴极,铜电极的电极反应式为9CO2+6H2O+8e-=CH4+8HCO3-, D正确;正确选项D。
的过程是一个还原反应过程,所以铜电极是电解池的阴极,铜电极的电极反应式为9CO2+6H2O+8e-=CH4+8HCO3-, D正确;正确选项D。

练习册系列答案
相关题目