题目内容
【题目】标准状况下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023个NH3分子。则
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
【答案】D
【解析】
A项,根据理想状态气体方程pV=nRT可知,同温同压下,气体的体积之比等于气体的物质的量之比,①9.6gCH4的物质的量为n(CH4)=![]() =0.6mol,②n(HCl)=1mol,③n(H2S)=
=0.6mol,②n(HCl)=1mol,③n(H2S)=![]() =0.8mol,④n(NH3)=
=0.8mol,④n(NH3)=![]() mol=0.4mol,四种气体物质的量的关系为②>③>①>④,体积之间的关系为②>③>①>④,故A项错误;
mol=0.4mol,四种气体物质的量的关系为②>③>①>④,体积之间的关系为②>③>①>④,故A项错误;
B项,根据理想状态气体方程推导可知pV=nRT,同温同压下,气体密度与气体的摩尔质量成正比,所以标况下,CH4、HCl、H2S、NH3的密度:②>③>④>①,故B项错误;
C项,m=nM,m1=9.6g,m2=1mol×36.5g/mol=36.5g,m3=0.8mol×34g/mol=27.2g ,m4=0.4mol×17g/mol=6.8g ,m2 >m3 >m1 >m4,所以四中气体质量的关系为:②>③>①>④,故C项错误;
D项,氢原子的个数与氢原子的物质的量呈正比,n1(H)=0.6×4mol=2.4mol,n2(H)=1×1mol=1mol,n3(H)=0.8×2mol=1.6mol,n4(H)=0.4×3mol=1.2mol,所以氢原子个数①>③>④>②,故D项正确。
综上所述,本题正确答案为D。

 阅读快车系列答案
阅读快车系列答案【题目】I.(1)键线式![]() 表示的有机物名称为__________。
表示的有机物名称为__________。
(2)A和B两种有机物可以互溶,其有关性质如表所示:
密度(20℃) | 熔点(℃) | 沸点(℃) | 溶解性 | |
A | 0.7137 g/mL | -116.6 | 34.5 | 不溶于水 |
B | 0.7893 g/mL | -117.3 | 78.5 | 与水以任意比混溶 |
要除去B中混有的少量A,可采用_________方法。
A.蒸馏 B.过滤 C.萃取 D.加水充分振荡,分液
Ⅱ.(1)扁桃酸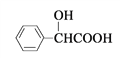 有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
有多种同分异构体,属于甲酸酯且含酚羟基的同分异构体共有_______种。
(2)分子式为C9H12 且属于苯的同系物的同分异构体的数目为_______
III.有下列各组物质:
(A)S2和S4
(B) ![]() 和
和![]()
(C)CH4和C8H18
(D) 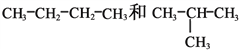
(E)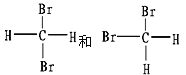
①_________组两物质互为同素异形体;
②_________组两物质互为同系物
IV.配平下列化学方程式,只需将配平后草酸的系数、二氧化氯的系数填入答题页上。
KClO3+______H2C2O4+H2SO4![]() _____ClO2↑+K2SO4+CO2↑+H2O
_____ClO2↑+K2SO4+CO2↑+H2O
【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
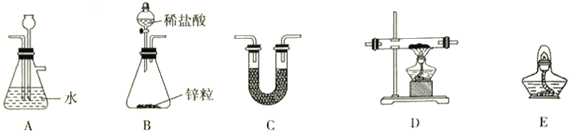
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
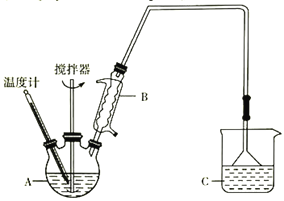
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂:

对实验现象的“解释或结论”正确的是
选项 | 实验现象 | 解释或结论 |
A | a中溶液褪色 | 氧化性:SO32-<I- |
B | b中无现象,加硫酸后产生淡黄色沉淀 | 硫酸将S2-氧化为硫单质 |
C | c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 | 亚硫酸钠溶液中存在水解平衡 |
D | d中产生白色沉淀 | Na2SO3溶液已变质 |
A. A B. B C. C D. D
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为_______________。
(2)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是___________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(3)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ。已知该化合物的熔、沸点分别为-69℃和58℃。写出该反应的热化学方程式:_____________。
(4)1mol碳与镁形成的化合物Q与4mo水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为____________。
(5)Q与水反应的化学方程式为_____________________。