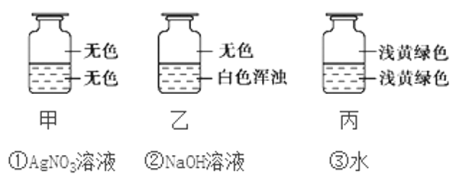
题目内容
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
【答案】C
【解析】放电时,Mg(液)层发生反应![]() ,Mg(液)层的质量减小,故A正确;放电时Mg—Sb(液)层是正极,正极反应为:Mg2++2e-=====Mg,故B正确;该电池充电时,Mg—Sb(液)层是阳极,发生氧化反应,故C错误;该电池充电时,上层是阴极、下层是阳极,C1-向阳极移动,故D正确。
,Mg(液)层的质量减小,故A正确;放电时Mg—Sb(液)层是正极,正极反应为:Mg2++2e-=====Mg,故B正确;该电池充电时,Mg—Sb(液)层是阳极,发生氧化反应,故C错误;该电池充电时,上层是阴极、下层是阳极,C1-向阳极移动,故D正确。

 阅读快车系列答案
阅读快车系列答案【题目】氯化亚铁常用于检测硒、污水处理等。制备FeCl2的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2,装置如下:
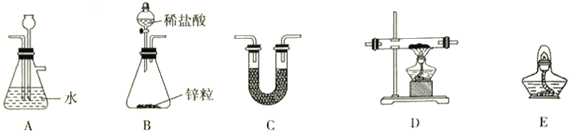
已知:FeCl2、FeCl3易吸水。
①H2还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为(可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g氯苯,控制反应温度在一定范围加热3h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。
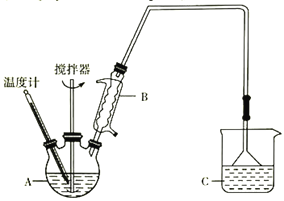
已知:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 | ||
熔点/℃ | -45 | 53 | _________ | _________ |
沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______gNaOH的溶液。