题目内容
10. 某研究性学习小组设计如图装置来证实稀硝酸与铜反应生成了NO.
某研究性学习小组设计如图装置来证实稀硝酸与铜反应生成了NO.(1)补充完成下列实验步骤:
①检查装置的气密性.
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞(或稀硝酸浸没铜丝)为止.
③关闭活塞A,观察实验现象.
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有无色气体产生,溶液呈蓝色,随着反应的不断进行,最后反应自行停止.该过程反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)为了进一步证明反应确实生成了NO,还需要的操作及看到的现象为打开活塞A,若干燥管中出现红棕色气体,则证明产生了NO气体,反之,则无.
(4)将2.56g铜粉与10mL浓硝酸反应,充分反应后收集到NO2和NO的混合气体体积为1.12L(标准状况下),测得溶液中剩余H+ 的物质的量浓度为1.0mol/L,则原浓硝酸的物质的量浓度为14.0mol/L(溶液体积变化忽略不计).
分析 (1)使稀硝酸接触到A处橡皮塞为止,注意不能使硝酸进入干燥管中;
(2)铜和稀硝酸反应生成硝酸铜和无色气体一氧化氮;
(3)一氧化氮易和氧气反应生成红棕色二氧化氮气体;
(4)n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,氮氧化物的物质的量n(气体)=$\frac{1.12L}{22.4L/mol}$=0.05mol,结合原子守恒及c=$\frac{n}{V}$计算.
解答 解:(1)将稀HNO3接触到A处橡皮塞为止,即把U形管左侧的空气排出,又使铜丝和硝酸反应,
故答案为:稀HNO3接触到A处橡皮塞(或稀硝酸浸没铜丝);
(2)铜和稀硝酸反应生成硝酸铜和一氧化氮气体,离子反应方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,一氧化氮气体是无色的,
故答案为:无;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)一氧化氮是无色气体,要证明生成一氧化氮,可根据二氧化氮的颜色判断是否有一氧化氮生成,一氧化氮和氧气反应生成红棕色二氧化氮,使一氧化氮和空气接触即可,即打开活塞A,有红棕色气体产生说明确实有一氧化氮生成,故答案为:打开活塞A,若干燥管中出现红棕色气体,则证明产生了NO气体,反之,则无;
(4)n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,氮氧化物的物质的量n(气体)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
测得溶液中剩余H+ 的物质的量浓度为1.0mol/L,即反应后溶液中硝酸的物质的量n(HNO3)=1.0mol/L×0.01L=0.01mol,
由氮原子守恒n(HNO3)=2n[Cu(NO3)2]+n(气体)+n(HNO3)剩余=0.04mol×2+0.05mol+0.01mol=0.14mol,
则硝酸的物质的量浓度c(HNO3)=$\frac{0.14mol}{0.01L}$=14.0mol/L,
故答案为:14.0mol/L.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、实验装置的作用、发生的反应为解答的关键,侧重分析与实验及计算能力的考查,题目难度不大.

| A. | CH3CH(CH2Br)2 | B. | (CH3)2C Br CH2 Br | ||
| C. | C2H5CH Br CH2 Br | D. | CH3(CH Br)2CH3 |
| A. | 将钠放入水中,钠将沉在水底 | |
| B. | 将一小块钠放在稀盐酸中,钠将与水反应生成NaOH和H2,生成的NaOH再与HCl反应生成NaCl和H2O | |
| C. | 将一小块钠放在CuSO4溶液中发生如下反应:2Na+CuSO4═Na2SO4+Cu | |
| D. | Na2O和Na2O2中,氧元素化合价不同 |
| A. | 1molCl2与足量的铁反应生成FeCl3,转移的电子数是3NA | |
| B. | 1mol氧气含有的原子数是1mol氖气含有的原子数的两倍 | |
| C. | 7.8g Na2O2中含有阴离子的数目为0.1NA,与足量水反应时电子转移了0.1NA | |
| D. | 在标准状况下,NA个水分子所占有的体积约为22.4L |
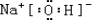 ;w属于非极性 (填“极性”或“非极性)分子;
;w属于非极性 (填“极性”或“非极性)分子; .A经①②两步反应得到C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示.
.A经①②两步反应得到C、D和E.B经①②两步反应得E、F和H.上述反应过程、产物性质及相互关系如图所示.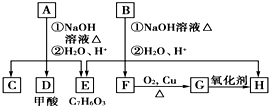
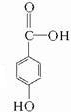 .
.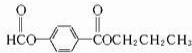 和
和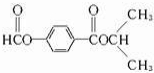 .
.