题目内容
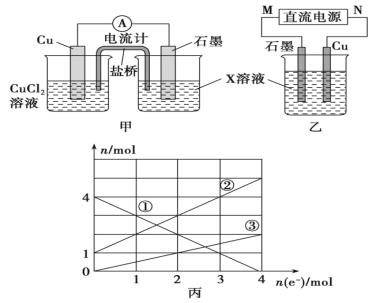
【题目】利用下图装置,可以模拟铁的电化学防护。下列说法正确的是( )

A. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于M处
B. 若X为锌,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
C. 若X为碳棒,K与M连接时,一段时间后溶液的pH减小
D. 若X为锌,K与N连接时,X电极产生气泡
【答案】B
【解析】
A.若X为碳棒,开关K置于M处构成原电池,铁是负极,铁被腐蚀,故A错误;
B.当X为锌,K置于M处时,构成原电池,铁作正极被保护,故B正确;
C.当X为碳棒,K置于M处时,仍构成原电池,铁作负极,总反应为2Fe+O2+2H2O=2Fe(OH)2↓,溶液的pH不会减小,故C错误;
D.若X为锌,当K置于N处时,构成电解池,Zn作阳极,电极反应Zn-2e-=Zn2+,故D错误;
答案:B

练习册系列答案
相关题目