题目内容
【题目】某反应中反应物与生成物有FeCl2、FeCl3、CuCl2、Cu。
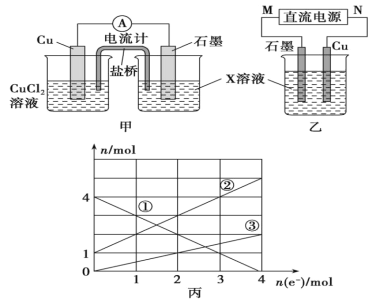
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是____(填化学式);
②Cu电极上发生的电极反应式为________;
③原电池工作时,电子通过电流计的方向是____(填“从左到右”或“从右到左”);盐桥中的____(填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是____极;
②图丙中的②线是____(填离子)的变化。
③当电子转移为2mol时,向乙烧杯中加入____L 5 mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠的生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是__________。
②高铁酸钠的生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______。
(4)向10mL1mol·L-1NH4Al(SO4)2溶液中滴加1mol·L-1NaOH溶液,沉淀的物质的量随加入NaOH溶液体积的变化如图所示(滴加过程无气体放出)。
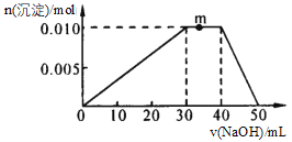
①写出m点发生反应的离子方程式____。
②若在该盐溶液中改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________mol。
【答案】FeCl3和FeCl2溶液 Cu-2e-=Cu2+ 从左到右 K+ 负 Fe2+ 2.8 Fe+8OH--6e-![]() Fe
Fe![]() +4H2O 2Fe(OH)3+3ClO-+4OH-
+4H2O 2Fe(OH)3+3ClO-+4OH-![]() 2Fe
2Fe![]() +3Cl-+5H2O NH4++OH-=NH3H2O 0.02
+3Cl-+5H2O NH4++OH-=NH3H2O 0.02
【解析】
(1)原电池中负极发生氧化反应,正极发生还原反应,电子由负极流向正极,溶液中的阳离子向正极移动,据此进行分析;
(2)①根据图丙可知,溶液中有三种阳离子,而根据X溶液的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,据此分析装置中的电解池的阴阳极和电源的正负极;
②根据转移电子的物质的量和金属阳离子的物质的量变化进行分析;
③当电子转移为2mol时,溶液中有Fe3+为2mol,Fe2+为3mol,Cu2+为1mol,据此计算出完全沉淀三种离子所需要加入NaOH的量,进而求出 NaOH溶液的体积;
(3)①电解时阳极发生氧化反应,因此根据Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑反应写出电解时阳极的电极反应式;
Na2FeO4+3H2↑反应写出电解时阳极的电极反应式;
②强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,据此写出该反应的离子方程式;
(4) ①向NH4Al(SO4)2溶液中滴加1mol·L-1NaOH溶液,0-30mL时,反应为:Al3++3OH-=Al(OH)3↓;30-40mL时,沉淀量不变,反应为:NH4++OH-=NH3H2O;40-50mL时,氢氧化铝溶解:Al(OH)3+OH-=AlO2-+2H2O;据此进行分析m点发生的反应;
②计算出20mL1.2mol·L-1Ba(OH)2溶液中n(Ba2+)和n(OH-)=0.048mol;10mL1mol·L-1NH4Al(SO4)2溶液中n(Al3+)和n(SO42-);然后根据Ba2++SO42-=BaSO4↓、Al3++3OH-=Al(OH)3↓、Al3++4OH-=AlO2-+2H2O进行分析计算出溶液中的沉淀量。
(1) ①根据反应物和生成物可以确定该反应为:2FeCl3+Cu=2FeCl2+CuCl2;结合图丙可知X溶液为FeCl3和FeCl2溶液;
故答案是:FeCl3和FeCl2溶液;
②Cu做负极,发生氧化反应,发生的电极反应式为Cu-2e-=Cu2+;
故答案是:Cu-2e-=Cu2+;
③原电池工作时,电子由负极流向正极,根据图甲可知,铜做负极,因此电子通过电流计的方向是从左到右;石墨电极为正极,阳离子向正极移动,所以盐桥中的K+不断进入X溶液中;
故答案是:从左到右;K+;
(2)①根据图丙可知,溶液中有三种阳离子,而根据X溶液的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此,铜做阳极,石墨做阴极,所以M是负极,N为正极;
故答案是:负;
②根据转移电子的物质的量和金属阳离子的物质的量变化,可以推知:①为Fe3+;②为Fe2+ ;③为Cu2+;
故答案是:Fe2+;
③当电子转移为2mol时,溶液中有Fe3+为2mol,Fe2+为3mol,Cu2+为1mol;所以需要加入NaOH的量为(2×3+3×2+1×2)mol=14mol时,才能保证上述三种阳离子沉淀完全,故NaOH溶液的体积为14mol÷5 mol·L-1=2.8L;
故答案是:2.8;
(3)①电解时阳极发生氧化反应,根据Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑反应可知,电解时阳极的电极反应式是:Fe+8OH--6e-
Na2FeO4+3H2↑反应可知,电解时阳极的电极反应式是:Fe+8OH--6e-![]() FeO42- +4H2O;
FeO42- +4H2O;
故答案是:Fe+8OH--6e-![]() FeO42-+4H2O;
FeO42-+4H2O;
②强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为. 2Fe(OH)3+3ClO-+4OH-![]() 2FeO42-+3Cl-+5H2O;
2FeO42-+3Cl-+5H2O;
故答案是:2Fe(OH)3+3ClO-+4OH-![]() 2FeO42-+3Cl-+5H2O;
2FeO42-+3Cl-+5H2O;
(4) ①向NH4Al(SO4)2溶液中滴加1mol·L-1NaOH溶液,0-30mL时,反应为:Al3++3OH-=Al(OH)3↓;30-40mL时,沉淀量不变,反应为:NH4++OH-=NH3H2O;40-50mL时,氢氧化铝溶解:Al(OH)3+OH-=AlO2-+2H2O;所以m点发生反应的离子方程式NH4++OH-=NH3H2O;
故答案是:NH4++OH-=NH3H2O;
②20mL1.2mol·L-1Ba(OH)2溶液中n(Ba(OH)2)=0.02L×1.2mol·L-1=0.024mol;n(Ba2+)0.024mol,n(OH-)=0.048mol;10mL1mol·L-1NH4Al(SO4)2溶液中n(NH4Al(SO4)2)=0.01L×1mol·L-1=0.01mol;n(Al3+)=0.01mol,n(SO42-)=0.02mol;根据Ba2++SO42-=BaSO4↓可知,n(Ba2+)过量,按n(SO42-)计算可知n(BaSO4)= n(SO42-)=0.02mol;根据Al3++4OH-=AlO2-+2H2O可知,如果n(Al3+)=0.01mol全部反应,消耗n(OH-)=0.04mol,已知n(OH-)=0.048mol,因此碱过量,没有沉淀产生;最终溶液中产生沉淀为硫酸钡,物质的量为0.02mol;
故答案是:0.02。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1个 |
C元素原子的第一至第四电离能分别是:I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
D原子核外所有p轨道全满或半满 |
E元素的主族序数与周期数的差为4 |
F是前四周期中电负性最小的元素 |
G在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有_____个方向,原子轨道呈___形
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为![]()
![]() 该同学所画的电子排布图违背了____。
该同学所画的电子排布图违背了____。
(3)G位于______族______区,价电子排布式为______。
(4)检验F元素的实验方法是_________。