题目内容
【题目】A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子层结构,则下列有关说法中,正确的是_____
A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键,NH5是离子化合物
C.NH5的电子式为![]()
D.它与水反应的化学方程式为NH5+H2O=NH3·H2O+H2↑
【答案】BCD
【解析】
NH5的所有原子的最外层都符合稳定结构,因此是铵根离子和氢离子,一个铵根离子带一个单位的正电荷,一个氢离子带一个单位的负电荷,整个物质对外不显电性。
A.NH5为离子化合物,为NH4H,1mol NH5中含有4NA个N-H键,A错误;
B.NH5为离子化合物,分子中存在NH4+和H-,含有离子键,N-H键共价键,B正确;
C.NH5为离子化合物,分子中存在NH4+和H-,电子式为![]() ,C正确;
,C正确;
D.NH5和水反应生成一水合氨和氢气,化学方程式为NH5+H2O=NH3·H2O+H2↑,D正确;
故选BCD。

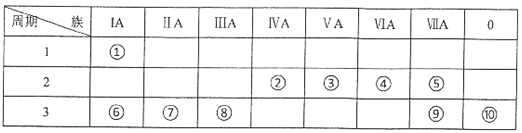
【题目】下表给出七种元素的相关信息,根据以下信息填空:
元素 | 相关信息 |
A | 核外电子数和电子层数相等 |
B | 基态原子2p能级有3个未成对电子 |
C | 在地壳中含量最高 |
D | 目前,在元素周期表中电负性最大 |
E | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
F | 原子序数等于D与E的原子序数之和 |
G | 基态原子2p能级上有两个空轨道 |
(1)写出D在元素周期表中的位置___________________。
(2)14gB的单质分子中π键的个数为____________。
(3)C元素的氢化物的沸点是同族元素氢化物中最高的,原因是________。
(4)B、C、D 3种元素的电负性由大到小的顺序为________(用元素符号表示)。
(5)写出一种与B2互为等电子体的分子或离子____________。
(6)已知BA5为离子化合物,写出其电子式:_______。
(7)第二周期中,第一电离能介于B元素和G 元素间的元素为 ____(填“元素符号”)。