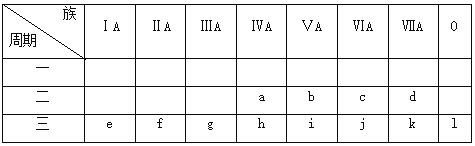
题目内容
【题目】HBr被![]() 氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
氧化依次由如下Ⅰ、Ⅱ、Ⅲ三步反应组成:
Ⅰ.HBr(g)+O2(g)=HOOBr(g);
Ⅱ.HOOBr(g)+HBr(g)=2HOBr(g);
Ⅲ.HOBr(g)+HBr(g)=H2O(g)+Br2(g)
1mol HBr(g)被氧化为![]() (g)放出
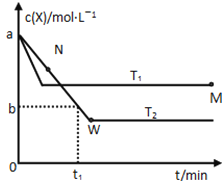
(g)放出![]() 热量,其能量与反应进程的关系如图所示:
热量,其能量与反应进程的关系如图所示:
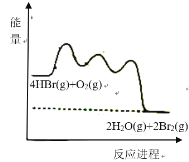
下列说法正确的是![]()
![]()
A.反应Ⅰ、Ⅱ、Ⅲ均为放热反应
B.Ⅰ的反应速率最慢
C.HOOBr比HBr和![]() 稳定
稳定
D.热化学方程式为:4HBr(g)+O2(g)=2H2O(g)+2Br2(g) ![]()
【答案】B
【解析】
A选项,第一步反应是反应物总能量低于生成物的总能量,所为吸热反应,故A错误;
B选项,第一步反应需要的活化能最大,即反应I的反应速率最慢,故B正确;
C选项,HOOBr的总能量比HBr和O2的总能量高,能量越高,物质越不稳定,故C错误;
D选项,根据题意,1mol HBr(g)被氧化为Br2(g)放出12.67kJ热量,则热化学方程式为4HBr(g)+O2(g)=2H2O(g)+2Br2(g) △H=-50.68kJ·mol-1,故D错误;
综上所述,答案为B。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目