题目内容
3.1 mo1水所占的积是1.8×10-5m3,设水分子是一个挨一个排列的,估算在1cm的长度上排列\frac{1}{\root{3}{30}}×1{0}^{8}\frac{1}{\root{3}{30}}×1{0}^{8}个水分子,相邻两个水分子的间距约为\root{3}{30}\root{3}{30}×10-10m.(已知水的密度为1×103kg/m3,NA=6.02×1023 mol -1,水的摩尔质量为18×10-3kg/mol)分析 1mol水的质量=1mol×18g/mol=18g=0.018g,水的密度为1×103kg/m3,根据V=mρmρ计算水的体积;1mol水中其分子个数为NA,先计算一个水分子体积,再计算在1cm的长度上排列水分子个数;根据体积公式计算水分子之间的距离.
解答 解:1mol水的质量=1mol×18g/mol=18g=0.018kg,水的密度为1×103kg/m3,水的体积V=mρmρ=0.018kg1000kg/m30.018kg1000kg/m3=1.8×10-5m3;
1mol水分子个数为NA,则每个水分子体积=1.8×10−5m36.02×10231.8×10−5m36.02×1023=3×10-29m3,水分子间距等于水分子直径=\root{3}{30}\root{3}{30}×10-10m,则1cm长度上排列水分子个数=\frac{0.01m}{\root{3}{30}×1{0}^{-10}m}\frac{0.01m}{\root{3}{30}×1{0}^{-10}m}=\frac{1}{\root{3}{30}}×1{0}^{8}\frac{1}{\root{3}{30}}×1{0}^{8},
故答案为:1.8×10-5m3;\frac{1}{\root{3}{30}}×1{0}^{8}\frac{1}{\root{3}{30}}×1{0}^{8};\root{3}{30}\root{3}{30}×10-10.
点评 本题考查物质的量的有关计算,侧重考查学生分析计算能力,注意计算时要将水分子可作是球形分子,题目难度不大.

练习册系列答案
相关题目
13.某水体溶有Ca2+、Mg2+、HCO3-三种离子,可先加足量消石灰,再加足量纯碱以除去Ca2+、Mg2+,以下离子方程式肯定不符合反应事实的是( )
| A. | Mg 2++2HC03-+Ca 2++2OH -→MgC03↓+CaC03↓+2H20 | |
| B. | Mg 2++2HC03-+2Ca 2++4OH -→Mg(OH)2↓+2CaC03↓+2H20 | |
| C. | Mg 2++3HC03-+3Ca 2++5OH -→Mg(OH)2↓+3CaC03↓+3H20 | |
| D. | Ca2++C032-→CaCO3↓ |
14.下列说法正确的是( )
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步均为氧化还原反应 | |
| C. | 可溶性铁盐和铝盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
11.某污水处理厂欲对含有Fe2+的废水进行处理(测定发现该废水的pH接近6).某科研小组现拟定下列方案对该污水进行处理:向废水中加入一定量的过氧化氢溶液,同时用电动搅拌棒适当搅拌,使其产生难溶物沉降下来,已达到除去Fe2+的目的.
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
(2)如表列出了Fe2+、Fe3+生成氢氧化物沉淀的pH值(开始沉淀的pH按照金属离子的物质的量浓度为0.01mol•L-1计算):
试写出废水中加入过氧化氢溶液搅拌时发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.Fe(OH)3的Ksp=1×10-37.4.该小组人员在实验中发现:若过氧化氢溶液加入过多,难溶物的沉降效果会变差,请分析原因:Fe3+可引起双氧水的分解产生氧气,大量的气泡影响了难溶物的沉降.
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
(1)科研小组为了研究影响上述方案的相关因素,在实验室中做了如表三组实验.请完成实验设计表(表中不要留空格):
| 编号 | 实验目的 | 污水的体积(mL) | 温度(℃) | 过氧化氢的质量分数 |
| ① | 为以下实验作参照 | 25 | 20 | 10% |
| ② | 过氧化氢浓度的影响 | 25 | 20 | 30% |
| ③ | 温度的影响 | 25 | 80 | 10% |
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe2+ | 7.4 | 8.9 |
| Fe3+ | 2.2 | 3.2 |
(3)小组人员发现:废水存放一段时间后,颜色发生了一定的变化.现取一定量的废水,对其中所含铁元素的存在形式进行研究.
①提出假设
假设一:只有Fe2+;
假设二:只有Fe3+;
假设三:两者都有.
②验证假设
为验证假设,请你设计一个实验方案,写出实验步骤、预期现象和结论:(限选试剂:稀HNO3溶液,稀NaOH溶液,KSCN溶液,KMnO4酸性溶液,淀粉KI溶液)
| 实验步骤 | 预期现象及结论 |
| 第一步,取少量废水于试管中,滴加几滴KSCN溶液,振荡,观察现象. | 如果无现象,则假设一成立,如果溶液变红,则进行下一步实验 |
| 另取少量废水于试管中,滴加少量的KMnO4酸性溶液,振荡,观察现象 | 如果紫色退去,则假设三成立;如果紫色未退去,则假设二成立 |
18.下列说法正确的是 ( )
| A. | 试管内壁的银镜可用玻璃棒将其刮下或浸泡氨水的方法清洗去除 | |
| B. | 为降低铜锌原电池中的极化作用,可在电解质溶液中加入少量双氧水 | |
| C. | 为检验CO气体的纯度,用排空气法收集一试管气体,然后移近酒精灯火焰点燃.听有无尖锐爆鸣声 | |
| D. | 用pH计、浊度计(浊度即水的浞浊程度.浊度计是测定水浊度的装置)均不可用于探究硫代硫酸钠与硫酸反应速率的影响因素 |
8.利用太阳光能分解水制氢气是未来解决能源危机的理想方法之一.某研究小组设计了如图所示的循环系统实现光能分解水制氢气.反应过程中所需的电能由太阳光能电池提供,反应体系中I2和Fe3+等可循环使用.则下列有关结论中不正确的是( )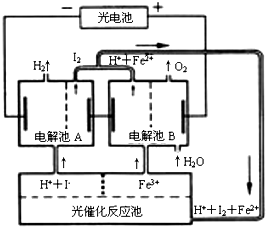

| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2光照_光照–––––Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
18.下列关于有机物性质的说法正确的是( )
| A. | 乙烯和甲烷在一定条件下都可以与氯气反应 | |
| B. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| C. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯和乙烷都可以与氢气发生加成反应 |
