题目内容
10.加入稀盐酸后,溶液中下列离子数目不减少的是( )| A. | CO32- | B. | SO42- | C. | Ag+ | D. | SO32- |
分析 盐酸电离出氢离子和氯离子,根据离子之间不能结合生成沉淀、气体、水等,则离子数目不减少,以此来解答.
解答 解:A.H+、CO32-结合生成水和气体,CO32-数目减少,故A不选;
B.氢离子和氯离子与SO42-均不反应,则SO42-数目不变,故B选;
C.Cl-、Ag+反应生成沉淀,则Ag+数目减少,故C不选;
D.H+、SO32-结合生成水和气体,SO32-数目减少,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.下列关于有机物性质的说法正确的是( )
| A. | 乙烯和甲烷在一定条件下都可以与氯气反应 | |
| B. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| C. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯和乙烷都可以与氢气发生加成反应 |
5.某气态烃1体积只能与1体积HBr发生加成反应,生成溴代烷,此溴代烷1mol可与7mol Cl2发生完全取代反应,则该烃的结构简式为( )
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH2=CH-CH=CH2 |
2.某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
实验一 配制并标定醋酸溶液的浓度取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.
回答下列问题:
(1)配制250mL 0.2mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定醋酸溶液的准确浓度,用0.2000mol.L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为0.2000mol•L-1.(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.0100mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”减小”或“不变”)
实验一 配制并标定醋酸溶液的浓度取冰醋酸配制250mL 0.2mol•L-1的醋酸溶液,用0.2mol•L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定.
回答下列问题:
(1)配制250mL 0.2mol•L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定醋酸溶液的准确浓度,用0.2000mol.L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol•L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:0.0100mol•L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1.
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将增大(填“增大”减小”或“不变”)
20.下列分子中,各分子的空间构型和中心原子的杂化方式均正确的是( )
| A. | NH3 平面三角形 sp3杂化 | B. | CCl4 正四面体 sp3杂化 | ||
| C. | H2O V形 sp2杂化 | D. | CO32- 三角锥形 sp3杂化 |
 ,D的结构式:
,D的结构式: .
. ;1124Na.
;1124Na.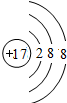 、
、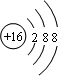 ;
;