题目内容
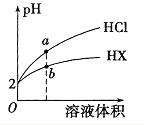
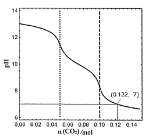
【题目】常温下,1L0.1mol·L-1的NaOH溶液中缓慢通入CO2,溶液的pH随CO2的物质的量变化如下图所示(实验过程中溶液体积变化忽略不计),下列说法正确的是
A.在整个过程中,溶液中一定不存在![]()
B.![]() 时,
时,![]()
C.当![]() 时,溶液中不存在H2CO3分子
时,溶液中不存在H2CO3分子
D.当![]() 时,一定有
时,一定有![]()
【答案】D
【解析】
1L0.1molL-1的NaOH溶液中缓慢通入CO2时,当通入0.05molCO2时两者恰好完全反应生成Na2CO3,当通入0.1molCO2时,两者恰好完全反应生成NaHCO3;
A.当通入的CO2为![]() mol时,剩余的NaOH和生成的Na2CO3的物质的量恰好相同,而CO32-能水解生成OH-,故当通入的二氧化碳的量稍多于
mol时,剩余的NaOH和生成的Na2CO3的物质的量恰好相同,而CO32-能水解生成OH-,故当通入的二氧化碳的量稍多于![]() mol时,溶液中可能会存在c(OH-)=c(CO32-),故A错误;
mol时,溶液中可能会存在c(OH-)=c(CO32-),故A错误;
B.当通入0.1molCO2时,两者恰好完全反应生成NaHCO3,而pH=7时,通入的CO2的物质的量为0.022mol,此溶液中含NaHCO3、CO2和H2CO3,由于HCO3-能电离且能水解,H2CO3能部分电离,故根据物料守恒可知n(CO32-)+n(H2CO3)+n(CO2)+n(HCO3-)=0.022mol,故B错误;
C.当n(CO2)=0.05mol时,两者恰好完全反应生成Na2CO3,CO32-能水解出H2CO3分子,含故溶液中含碳酸分子,故C错误;
D.当n(CO2)=0.05mol时,两者恰好完全反应生成Na2CO3,根据物料守恒可知有c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故有有c(Na+)>c(CO32-)+c(HCO3-),故D正确;
故答案为D。

练习册系列答案
相关题目