题目内容
【题目】制取氯化铁粉末所需装置如下,已知氯化铁粉末很容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。
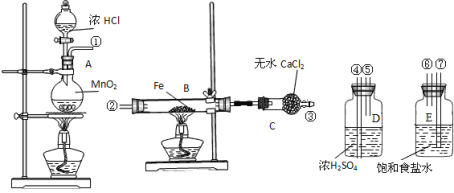
(1)按照气体流向从左到右顺序连接仪器应是①接_____,____接______,____接_______。
(2)烧瓶A中发生的反应_________________,B中反应的现象是____________。
(3)容器D的作用是_______,容器E的作用是_________。
(4)实验时应先点燃__处(填“A”或“B”)的酒精灯,理由是___________________________。
(5)这套实验装置是否完整?___(填“是”或“否”),若不完整,还须补充___________装置(若第一问填“是”,则此问不需要作答)。
【答案】⑦ ⑥ ④ ⑤ ② MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O 剧烈燃烧,产生棕褐色烟 吸收水分 吸收氯气中的氯化氢气体 A 使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化 否 装有氢氧化钠溶液的烧杯(或尾气吸收)
MnCl2+ Cl2+2H2O 剧烈燃烧,产生棕褐色烟 吸收水分 吸收氯气中的氯化氢气体 A 使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化 否 装有氢氧化钠溶液的烧杯(或尾气吸收)
【解析】
制取无水FeCl3,由实验装置可知,A中发生MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O,后面连接E除去氯气中的HCl,再连接D干燥氯气,然后连接B,B中发生3Cl2+2Fe
MnCl2+ Cl2+2H2O,后面连接E除去氯气中的HCl,再连接D干燥氯气,然后连接B,B中发生3Cl2+2Fe![]() 2FeCl3,C中可吸收水,防止空气中水进入B中,该实验还需要尾气处理装置,以此解答。
2FeCl3,C中可吸收水,防止空气中水进入B中,该实验还需要尾气处理装置,以此解答。
(1)由上述分析可知,装置为A→E→D→B→C,按照气体流向从左到右的顺序连接仪器的接口为①接⑦,⑥接④,⑤接,故答案为:⑦;⑥;④;⑤;②;
(2)A装置的烧瓶中发生反应的离子方程式为MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O,B装置中发生反应的化学方程式为3Cl2+2Fe
MnCl2+ Cl2+2H2O,B装置中发生反应的化学方程式为3Cl2+2Fe![]() 2FeCl3,现象为:剧烈燃烧,产生棕褐色烟;故答案为:MnO2+4HCl(浓)
2FeCl3,现象为:剧烈燃烧,产生棕褐色烟;故答案为:MnO2+4HCl(浓) ![]() MnCl2+ Cl2+2H2O;剧烈燃烧,产生棕褐色烟;
MnCl2+ Cl2+2H2O;剧烈燃烧,产生棕褐色烟;
(3)D装置的作用是吸收水分;E装置的作用是吸收氯气中的氯化氢气体,故答案为:吸收水分;吸收氯气中的氯化氢气体;
(4)实验开始时,应先点燃 A处的酒精灯,使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化,故答案为:A;使制取的Cl2排尽装置内的空气,防止铁被空气中的氧气氧化;
(5)这套实验装置不完整,还须补充装有氢氧化钠溶液的烧杯(或尾气吸收),故答案为:否;装有氢氧化钠溶液的烧杯(或尾气吸收)。

【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
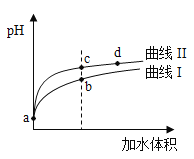
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.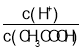 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。