题目内容
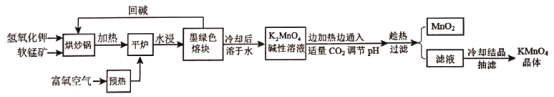
【题目】高锰酸钾(KMnO4)是常用的氧化剂。以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体的操作流程如下:
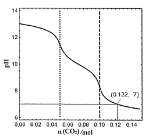
相关资料:①物质溶解度

②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是_____,上述流程中趁热过滤的目的是___。
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:____。
(3)下列有关上述流程及操作说法正确的是_____。
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是______。
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是___。
【答案】增大接触面积,加快反应速度 防止高锰酸钾析出 3MnO42-+3CO2+2OH-=2MnO4-+MnO2↓+H2O+3CO32- BD D 温度过高,产品受热分解
【解析】
软锰矿与氢氧化钾在烘炒锅里和氧气反应生成了墨绿色熔块,可得到K2MnO4,冷却溶于水后得到K2MnO4的碱性溶液,通入CO2调节pH,离子反应为3MnO42-+3CO2+2OH-=2MnO4-+MnO2↓+H2O+3CO32- ,趁热过滤、冷却结晶可得到KMnO4,据此分析。
(1)将软锰矿粉碎,增大了接触面积,能加快反应速率;KMnO4的溶解度随温度的升高而升高,因此需要趁热过滤;
(2)通入适量的CO2时与K2MnO4碱性溶液反应得到MnO2和KMnO4,离子反应为:3MnO42-+3CO2+2OH-=2MnO4-+MnO2↓+H2O+3CO32-;
(3)A.平炉反应中锰元素化合价升高,失电子,做还原剂,A项错误;
B.二氧化碳用醋酸代替,醋酸钾的溶解度大于碳酸钾,远大于高锰酸钾,降温结晶时不会随着高锰酸钾一起结晶出来,会使得到的产物纯度更高,如 CO2用硫酸溶液代替,硫酸钾的溶解度和高锰酸钾接近,降温时会和高锰酸钾一起析出,使得到的产品不纯,所以不能用盐酸和硫酸代替二氧化碳,B项正确;
C. 抽滤前,应先将滤纸放入布氏漏斗中,用蒸馏水润湿,微开水龙头,使滤纸紧贴漏斗的瓷板上,C项错误;
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头,D项正确;
答案选BD。
(4)高锰酸钾的溶解度随温度的降低而减低,因此洗涤KMnO4晶体最好的试剂是冷水;
(5)由于温度过高晶体会受热分解,故应把温度控制在80℃。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案