题目内容
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向剩余的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A.等于0.6molB.小于0.6mol
C.大于0.6mol,小于1.2molD.等于1.2mol
【答案】C
【解析】
100mL 12 mol/L的浓盐酸物质的量![]() ,
,
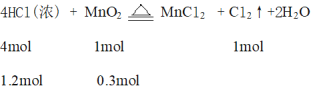
浓盐酸不断反应,浓度降低,变为稀盐酸不再反应,因此产生的氯气小于0.3mol,溶液中剩余的n(Cl-) > 1.2mol – 0.3mol×2=0.6mol,剩余的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量大于0.6mol,小于1.2mol,故C正确。
综上所述,答案为C。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】I.(1)下列右侧对左侧物质的描述与左侧任何物质都不对应的是_________(填右侧小写的编号);
物质 描述
A.四氧化三铁 a.自来水消毒剂
B.过氧化钠 b.工业制玻璃
C.碳酸氢钠 c.红色油漆和涂料
D.硅酸钠 d.木材防火剂
E.明矾 e.呼吸面具中氧气的来源
F.青铜 f.制光纤的材料
G.硅 g.用量最大的金属材料
H.氯气 h.焰色反应为绿色
II.(2)明矾溶液中加少量Ba(OH)2溶液的离子方程式 ______________;
(3)漂白粉溶液中通过量CO2的离子方程式________________;
(4)将KFe2Si3O8(OH)2改写为氧化物的形式________________,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,消耗HCl的物质的量为________mol;
(5)配平下面的离子方程式,并用双线桥表示反应的电子转移:______
SO32- + MnO4- + — SO42-+ Mn2+ +______
III.(6)若要除去下列物质中的杂质(括号内为杂质),请将选用的试剂填入表格。
物质(杂质) | 试剂 |
NaHCO3溶液(Na2CO3) | ①______ |
FeCl3溶液(FeCl2) | ②______ |
SiO2(CaCO3) | ③______ |
Fe2O3(SiO2) | ④______ |
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.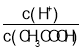 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。