题目内容
【题目】(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=____________;用离子方程式表示FeCl3溶液用于净水的原因____________________________________。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。在NaHSO4溶液中c(H+)___________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH__________7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为_________________________________。(已知Ksp(BaSO4)=1.1×10-10)
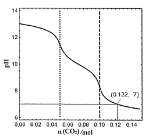
(4)一定温度下,测得某纯水的pH为6.5。此时水的离子积常数Kw为_______;若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1的Ba(OH)2溶液,保持原温度,其溶液的pH为__________。
【答案】10-2mol/L Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ = > 2.2×10-8mol/L 10-13 11
Fe(OH)3(胶体)+3H+ = > 2.2×10-8mol/L 10-13 11
【解析】
(1)氯化铁属于强酸弱碱盐,铁离子水解导致溶液呈酸性,25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=c(H+);
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-,溶液中存在电荷守恒,根据电荷守恒判断c(H+)和c(OH-)+c(SO42-)的相对大小;用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者反应生成硫酸钡、氢氧化钠和水,则反应后溶液呈碱性;
(3)计算混合后硫酸根的浓度,根据Ksp(BaSO4)=c(Ba2+)c(SO42-)计算硫酸根沉淀时溶液中c(Ba2+),原氯化钡溶液为此时钡离子浓度的2倍,注意溶液混合后各种物质的浓度降为原来的一半;
(4)纯水中,c(H+)=c(OH-),Kw=c(H+)×c(OH-);先计算氢氧根离子浓度,再根据离子积常数计算氢离子浓度,从而计算溶液的pH;
(1)氯化铁属于强酸弱碱盐,铁离子水解导致溶液呈酸性,25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=c(H+)=10-2mol/L,水解离子方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+;
Fe(OH)3(胶体)+3H+;
(2)NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-,溶液中存在电荷守恒c(H+)+c(Na+)=c(OH-)+2c(SO42-),物料守恒c(Na+)=c(SO42-),所以得c(H+)=c(OH-)+c(SO42-);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,二者反应生成硫酸钡、氢氧化钠和水,反应方程式为NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,溶液中的溶质是NaOH,则溶液呈碱性,pH>7;
(3)等体积混合后,c(SO42-)=![]() ×0.02mol/L=0.01mol/L,故BaSO4沉淀所需Ba2+离子的最小浓度为c(Ba2+)=
×0.02mol/L=0.01mol/L,故BaSO4沉淀所需Ba2+离子的最小浓度为c(Ba2+)=![]() mol/L=1.1×10-8mol/L,故原BaCl2溶液的浓度为2×1.1×10-8mol/L=2.2×10-8mol/L;
mol/L=1.1×10-8mol/L,故原BaCl2溶液的浓度为2×1.1×10-8mol/L=2.2×10-8mol/L;
(4)纯水中,c(H+)=c(OH-),Kw=c(H+)×c(OH-)=10-13;该溶液中,c(OH-)=2c(Ba(OH)2)=2×0.005molL-1=1.0×10-2 molL-1,c(H+)=![]() mol/L=10-11mol/L,所以溶液的pH=11。
mol/L=10-11mol/L,所以溶液的pH=11。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】I.(1)下列右侧对左侧物质的描述与左侧任何物质都不对应的是_________(填右侧小写的编号);
物质 描述
A.四氧化三铁 a.自来水消毒剂
B.过氧化钠 b.工业制玻璃
C.碳酸氢钠 c.红色油漆和涂料
D.硅酸钠 d.木材防火剂
E.明矾 e.呼吸面具中氧气的来源
F.青铜 f.制光纤的材料
G.硅 g.用量最大的金属材料
H.氯气 h.焰色反应为绿色
II.(2)明矾溶液中加少量Ba(OH)2溶液的离子方程式 ______________;
(3)漂白粉溶液中通过量CO2的离子方程式________________;
(4)将KFe2Si3O8(OH)2改写为氧化物的形式________________,1mol KFe2Si3O8(OH)2和足量稀盐酸反应,消耗HCl的物质的量为________mol;
(5)配平下面的离子方程式,并用双线桥表示反应的电子转移:______
SO32- + MnO4- + — SO42-+ Mn2+ +______
III.(6)若要除去下列物质中的杂质(括号内为杂质),请将选用的试剂填入表格。
物质(杂质) | 试剂 |
NaHCO3溶液(Na2CO3) | ①______ |
FeCl3溶液(FeCl2) | ②______ |
SiO2(CaCO3) | ③______ |
Fe2O3(SiO2) | ④______ |
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.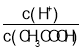 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。