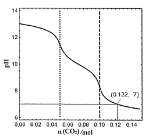
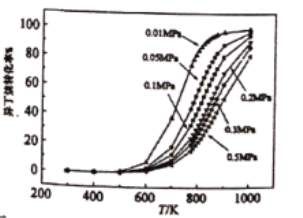
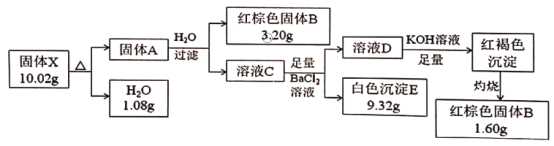
题目内容
【题目】某固体混合物可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的一种或几种,将该混合物进行如下实验:
中的一种或几种,将该混合物进行如下实验:
①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体
由上述现象推断:
(1)该混合物中一定含有________,一定不含有________,可能含有________。
(2)若要检验可能含有的物质是否存在,可以采用的实验操作为_____(填写字母)。
A.取步骤①中滤液,加入![]() 溶液
溶液
B.取步骤①中滤液,加入NaOH溶液
C.取步骤①中滤液,加入足量![]() 溶液,静置后在上层清液中加入硝酸酸化
溶液,静置后在上层清液中加入硝酸酸化![]() 溶液
溶液
D.取步骤①中滤液,加入足量![]() 溶液,静置后上层清液中加入硝酸酸化
溶液,静置后上层清液中加入硝酸酸化![]() 溶液
溶液
【答案】CaCO3、Na2SO4 Ba(NO3)2 、CuSO4 MgCl2 BC
【解析】
根据①混合物溶于水得到无色溶液,而CuSO4溶液呈蓝色的,可以确定一定不含有CuSO4。根据②焰色反应呈黄色,说明存在Na+,混合物中肯定含有Na2SO4。根据③白色沉淀加入稀盐酸,沉淀完全溶解并放出气体,说明混合物中能与Na2SO4反应生成不溶于稀盐酸的BaSO4沉淀的Ba(NO3)2一定不存在,则原固体中一定存在CaCO3。综上所述,该混合物中一定含有CaCO3、Na2SO4;一定不含有Ba(NO3)2 、CuSO4,可能含有MgCl2,以此解答。
(1)由分析可知,该混合物中一定含有CaCO3、Na2SO4;一定不含有Ba(NO3)2 、CuSO4;可能含有MgCl2;
(2)若要检验MgCl2是否存在,可以通过检验其中的Mg2+或者Cl-。检验Mg2+可以在步骤①中滤液加入NaOH溶液,根据是否产生白色沉淀来证明。检验Cl-可以在步骤①中滤液加入AgNO3溶液,但由于原固体中存在Na2SO4,与AgNO3溶液反应也要生成白色沉淀,故需先除去SO42-,即取步骤①中滤液,加入足量Ba(NO3)2溶液,静置后在上层清液中加入酸化AgNO3溶液。故选BC。

 科学实验活动册系列答案
科学实验活动册系列答案