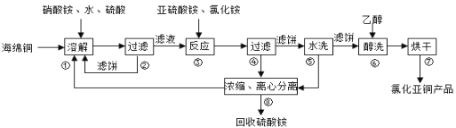
题目内容
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:
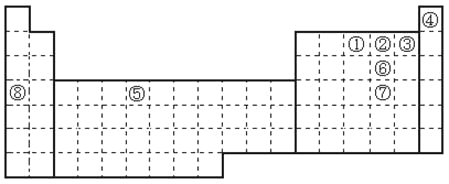
(1)写出①~⑧号元素中第一电离能最大的元素符号___________。
(2)写出②⑥⑦三个元素气态氢化学的沸点顺序___________。(填分子式顺序)
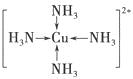
(3)请画出[Cu(NH3)4]2+离子结构示意图___________。
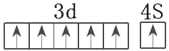
(4)请画出⑤的外围电子排布图___________。
(5)SeO3的空间构型为___________。
(6)SeO32-离子的VSEPR构型为___________。
【答案】1)He
(2)H2O>H2Se>H2S
(3)
(4)
(5)平面三角形
(6)四面体型
【解析】试题分析:根据元素在周期表中的位置可判断元素①~⑧分别是N、O、F、He、Cr、S、Se、K。
(1)稀有气体元素最外层电子达到稳定结构,第一电离能增大,则①~⑧号元素中第一电离能最大的元素符号为He。
(2)由于水分子间存在氢键,其氢化物在同主族元素形成的氢化物中沸点最高,则②⑥⑦三个元素气态氢化学的沸点顺序为H2O>H2Se>H2S。
(3)氨气含有孤对电子,铜离子含有空轨道,则[Cu(NH3)4]2+离子中含有配位键,其离子的结构示意图为 。
。
(4)Cr的原子序数是24,根据全充满或半充满状态稳定可知其外围电子排布图为
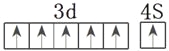 。
。
(5)SeO3的中心原子Se价层电子对数是3,且不存在孤对电子,所以空间构型为平面三角形;
(6)SeO32-离子的中心原子Se价层电子对数是3+![]() =4,所以其VSEPR构型为四面体。
=4,所以其VSEPR构型为四面体。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
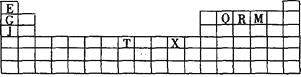

(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。