题目内容
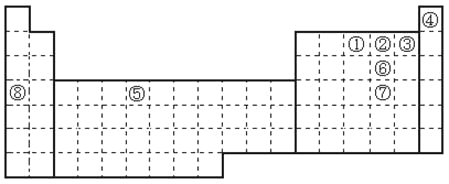
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
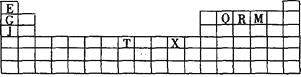

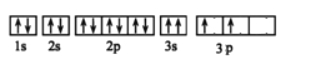
(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。
【答案】(1)1s22s22p63s23p63d5d区
(2)N>O>C C、N、O原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大,但O价电子排布为2s22p4,而N的价电子排布为2s22p3,p电子排布处于半充满状态,更稳定,电离能大
(3)BD
(4)高 Li+半径比Na+小,Li2O晶格能大
(5)Li 1分
【解析】试题分析:(1)T为Fe,原子序数为26,Fe3+的核外电子为23,根据核外电子排布规律可知其电子排布为[Ar]3d5或1s22s22p63s23p63d5。区的名称来自于按照构造原理最后填入电子的轨道名称,因此铁位于d区。
(2)C、N、O原子半径依次减小,原子核对外层电子的吸引力依次增强,元素的第一电离能依次增大,但O价电子排布为2s22p4,而N的价电子排布为2s22p3,p电子排布处于半充满状态,更稳定,电离能大,所以第一电离能为N>O>C。
(3)A.J为Na,X为Cu,Na的活泼性强与水反应,所以在溶液中不能置换出Cu,A错误;B.J2M2为Na2O2,化学反应中化学键断裂,将J2M2溶于水生成氢氧化钠和氧气,要破坏离子键和共价键,B正确;C.氨气中存在氢键,所以氨气的沸点高,C错误;D.一个C2H4分子中含有4个C-H键,1个碳碳双键,双键是由1个σ键和一个π键构成的,因此含有五个σ键和一个π键,D正确,答案选BD。
(4)G为Li,J为Na,离子半径越小,金属键越强,Li离子半径小,所以熔点高。
(5)G与R单质直接化合生成一种离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子水为6×![]() =2,Li3N中离子个数为3:1,所以层与层之间还原子为Li。
=2,Li3N中离子个数为3:1,所以层与层之间还原子为Li。

 名校课堂系列答案
名校课堂系列答案