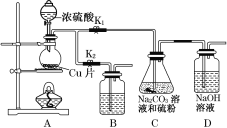
题目内容
【题目】黄铜矿(主要成分为CuFeS2 ,S为-2价)是工业炼铜的主要原料,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,设计了如下实验:

现称取研细的黄铜矿样品1.84g,在空气存在下进行煅烧,发生如下反应:![]()
实验后取d中溶液的![]() 置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
置于锥形瓶中,用0.0500mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)中氧化产物是 ,当生成0.3molSO2气体时,转移电子 mol。
(2)将样品研细后再反应,其目的是 ;装置c的作用是 。
(3)用标准碘溶液滴定d中溶液的离子方程式是 ,滴定达终点时的现象是 。
(4)上述反应结束后,仍需通一段时间的空气,其目的是 。
(5)通过计算可知,该黄铜矿的纯度为 。
(6)若将原装置d中的试液换为Ba(OH)2溶液,测得黄铜矿纯度偏高,假设实验操作均正确,可能的原因主要是 。
【答案】(1)Fe3O4 、SO2;1.9
(2)增大接触面积,使原料充分反应,加快反应速率 除去反应后多余的氧气
(3)SO2+I2+2H2O=SO42-+2I-+4H+ 锥形瓶中的溶液由无色变为蓝色且半分钟不褪色
(4)使反应生成的SO2全部进入d装置中,以减少实验误差。
(5)50%
(6)空气中的CO2与Ba(OH)2反应生成BaCO3沉淀(或BaSO3被氧化成BaSO4)
【解析】
试题分析:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度;(1)CuFeS2,S为-2价元素Cu元素化合价+2价,Fe元素化合价为+2价,反应后铜元素化合价降低,铁元素化合价升高,硫元素化合价升高,氧元素化合价降低,氧化产物是元素化合价升高的被氧化得到氧化产物,氧化产物为:Fe3O4、SO2,依据电子守恒计算电子转移总数,反应中3Cu2+~3Cu~6e-,8O2~Fe3O4+6SO2~32e-,生成6molSO2,电子转移总数为38mol,当生成0.3molSO2气体时1.9mol电子,故答案为:Fe3O4、SO2;1.9;
(2)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,灼热的铜网可以除去多余的氧气;
(3)用标准碘溶液滴定d中溶液的反应是二氧化硫被溴单质氧化生成硫酸和氢溴酸,反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝且半分钟不褪色,证明反应达到反应终点;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,使反应生成的SO2全部进入d装置中,以减少实验误差;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:0.92g/1.84g×100%=50%;
(6)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀(或BaSO3被氧化成BaSO4)。

【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。