题目内容
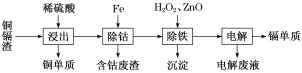
【题目】湿法炼锌产生的铜镉渣主要含锌、镉(Cd)、铜、铁、钴(Co)等金属单质。利用铜镉渣可生产Cu、Cd及ZnSO4·7H2O 等,其生产流程如图:
如表是部分金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.9 | 7.0 | 7.2 | 5.4 |
沉淀完全的pH | 3.2 | 9.0 | 9.5 | 8.2 |
请回答下列问题:
(1)提高铜镉渣的“浸出”速率的措施有________________________________(写出1条即可)。
(2)Fe的金属性比Co强,该流程中“除钴”________(填“能”或“不能”)用Zn代替Fe,“除钴”中Fe发生反应的离子方程式是__________________________________。
(3)“除铁”操作中加入H2O2的目的是______________________________,加入ZnO的目的是调节溶液pH,以除去溶液中的铁元素,调节溶液pH的范围为_________,“除铁”操作中的沉淀成分是__________(写化学式)。
(4)“电解”操作中,Cd2+在________极放电得到金属Cd,电极反应式是________________________。
(5)“电解”后的电解废液是ZnSO4溶液,用该电解废液制备ZnSO4·7H2O的方法是__________________。
(6)“除钴”后的含钴废渣在空气中煅烧,煅烧后的成分测定如表:
元素 | Co | Zn | Cu | Fe |
含量/% | 59.00 | 0.52 | 0.20 | 13.16 |
则煅烧后所得固体混合物中,钴氧化物的化学式是________。
【答案】适当升高浸取液温度(或将铜镉渣磨制成粉末等) 能 Fe+Co2+=Fe2++Co 将Fe2+氧化成Fe3+ 3.2~5.4 Fe(OH)3 阴 Cd2++2e-=Cd 蒸发浓缩、冷却结晶、过滤 Co3O4
【解析】
用湿法炼锌产生的铜镉渣生产金属镉的流程:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质,加入稀硫酸,铜不溶,过滤,滤液含有Zn2+、Fe2+、Cd2+、Zn2+、Co2+,向滤液加入锌,活化剂Sb2O3,锌粉会与Sb2O3等形成微电池产生合金CoSb除去钴,向除钴后的溶液中加入酸性高锰酸钾氧化Fe2+为Fe3+,高锰酸钾生成不溶的二氧化锰,加入氧化锌调节pH使Fe3+沉淀与二氧化锰一起过滤除去,电解含有Zn2+、Co2+的溶液,可得镉单质,据此分析解答。
(1)升高温度、增大反应物表面积等均可提高反应速率。
(2)Zn的金属性比Fe强。除钴中Fe与Co2+发生置换反应生成Fe2+和Co。
(3)H2O2可氧化Fe2+,使之转化为Fe3+。根据表格中的数据将Fe3+完全转化成Fe(OH)3 沉淀。
(4) Cd2+在阴极得电子生成单质Cd。
(5)从ZnSO4溶液中制备ZnSO4·7H2O的方法是蒸发浓缩、冷却结晶、过滤。
(6)由题意知,煅烧后所得固体为钴氧化物、ZnO、CuO、Fe2O3的混合物。
(1)升高温度、增大反应物表面积等均可提高反应速率。
(2)因Zn的金属性比Fe强,故可用Zn代替铁除钴。除钴中Fe与Co2+发生置换反应生成Fe2+和Co。
(3)H2O2可氧化Fe2+,使之转化为Fe3+。根据表格中的数据,可知欲除去溶液中的铁元素,需加入ZnO调节溶液pH的范围为3.2~5.4,此时Fe3+完全转化成Fe(OH)3 沉淀。
(4)电解操作中Cd2+在阴极得电子生成单质Cd。
(5)从ZnSO4溶液中制备ZnSO4·7H2O的方法是蒸发浓缩、冷却结晶、过滤。
(6)由题意知,煅烧后所得固体为钴氧化物、ZnO、CuO、Fe2O3的混合物,设煅烧后所得固体质量为100 g,结合题表中的数据可知,钴氧化物中m(O)=100 g-59.00 g-81 g·mol-1×![]() -80 g·mol-1×
-80 g·mol-1×![]() -160 g·mol-1×
-160 g·mol-1×![]() =21.302 g,则钴氧化物中n(O)=
=21.302 g,则钴氧化物中n(O)=![]() ≈1.33 mol,n(Co)=
≈1.33 mol,n(Co)=![]() =1.00 mol,故钴氧化物的化学式为Co3O4。
=1.00 mol,故钴氧化物的化学式为Co3O4。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)______________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为H1、H2、H3,则H1、H2、H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.4 | 20.6 | 23.6 |
4 | 20.1 | 20.3 | 26.9 |
依据该学生的实验数据计算,该实验测得的中和热H_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。