题目内容
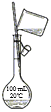
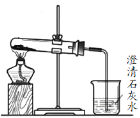
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol/L盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,混合均匀,测得混合液最高温度。
回答下列问题:
(1)写出该反应的热化学方程式(已知生成lmol液态水的反应热为-57.3kJ/mol)______________________。
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1L1mol/L盐酸恰好完全反应,其反应热分别为H1、H2、H3,则H1、H2、H3的大小关系为________________________。
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和反应后生成溶液的比热容c=4.18J/(g·℃),为了计算中和热,某学生实验记录数据如表:
实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.4 | 20.6 | 23.6 |
4 | 20.1 | 20.3 | 26.9 |
依据该学生的实验数据计算,该实验测得的中和热H_____(结果保留一位小数)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量__________ (填“相等、不相等”),所求中和热__________(填“相等、不相等”)。
(5)利用简易量热计测量室温下盐酸与氢氧化钠溶液中和反应的反应热,下列措施不能提高实验精度的是(_______)
A.利用移液管(精确至0.01 mL)代替量筒(精确至0.1 mL)量取反应液
B.快速将两溶液混合,匀速搅拌并记录最高温度
C.在内、外筒之间填充隔热物质,防止热量损失
D.用量程为500℃的温度计代替量程为100℃的温度
【答案】HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol △H1=△H2<△H3 -51.8kJ/mol 不相等 相等 D
【解析】
(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol;
(2)NaOH、Ca(OH)2都属于强碱,一定量的稀氢氧化钠溶液、稀氢氧化钙溶液和1L 1molL-1的稀盐酸恰好完全反应放热57.3kJ;一水合氨是弱电解质,存在电离平衡,电离过程是吸热程,稀氨水和1L 1molL-1的稀盐酸恰好完全反应放热小于57.3kJ,放热反应的H<0,所以△H1=△H2<△H3;
(3)第1次实验盐酸和NaOH溶液起始平均温度为20.1℃,反应后温度为:23.2℃,反应前后温度差为:3.1℃;第2次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.4℃,反应前后温度差为:3.1℃;第3次实验盐酸和NaOH溶液起始平均温度为20.5℃,反应后温度为:23.6℃,反应前后温度差为:3.1℃;第4次实验盐酸和NaOH溶液起始平均温度为20.2℃,反应后温度为:26.9℃,反应前后温度差为:6.7℃,误差太大,舍去;则实验中平均温度差为3.1℃,50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.18J/(g℃),代入公式Q=cm△t得生成0.025mol的水放出热量Q=4.18J/(g℃)×100g×3.1℃=12958J=1.2958kJ,即生成0.025mol的水放出热量为:1.2958kJ,所以生成1mol的水放出热量为1.2958kJ×![]() =51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol;
=51.8kJ,即该实验测得的中和热△H=-51.8kJ/mol;
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增多,但是中和热是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,测得中和热数值相等,故答案为:不相等;相等;
(5)A、提高所用试剂量的准确度可提高测量反应热的精确度;
B、能减少热量散失,可提高实验精度;
C、能减少热量散失,可提高实验精度;
D、温度计用500℃量程,最小刻度变大,测定温度不准确,使实验精度降低。
答案选D。

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
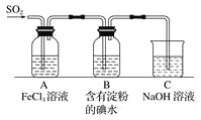
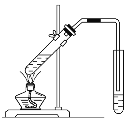
启东小题作业本系列答案【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。