题目内容
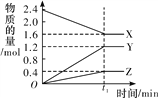
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。
【答案】![]()
![]() 1 4 2 3
1 4 2 3 ![]()
【解析】
本题考查化学反应速率的计算,利用速率之比等于化学计量数之比求得。可以利用三段式找到起始量、转化量、2min末,分析已知数据得出该反应是从右向左进行。
对比![]() 的起始量和2
的起始量和2![]() 末的量,可知反应逆向进行。
末的量,可知反应逆向进行。
![]() 。
。
对反应过程作三段式法分析如下:
mX(g) +nY(g)![]() pZ(g) +qQ(g)
pZ(g) +qQ(g)
始/mol 0.7 n(Y) 1 n(Q)
变/mol △n(X) △n(Y) △n(Z) 0.3
2min末/mol 0.8 2.7 0.8 2.7
故![]()
![]()
![]()
因![]() ,
,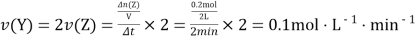 ,
,
所以![]() ,
,
![]() 。
。
故答案为(1).n(Y)=2.3mol, n(Q)=3 mol
(2)方程式中化学计量数之比等于各物质的物质的量浓度的变化量之比,
m:n:p:q = △n(X):△n(Y):△n(Z):△n(Q)=0.1 mol:0.4 mol:0.2 mol:0.3 mol=1:4:2:3,故答案为1,4,2,3;
(3)已知2min内![]() ,υ(Z):υ(Q)=2:3,知υ(Z)=
,υ(Z):υ(Q)=2:3,知υ(Z)=![]() ,故答案为
,故答案为![]() 。
。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】湿法炼锌产生的铜镉渣主要含锌、镉(Cd)、铜、铁、钴(Co)等金属单质。利用铜镉渣可生产Cu、Cd及ZnSO4·7H2O 等,其生产流程如图:
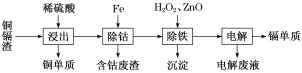
如表是部分金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.9 | 7.0 | 7.2 | 5.4 |
沉淀完全的pH | 3.2 | 9.0 | 9.5 | 8.2 |
请回答下列问题:
(1)提高铜镉渣的“浸出”速率的措施有________________________________(写出1条即可)。
(2)Fe的金属性比Co强,该流程中“除钴”________(填“能”或“不能”)用Zn代替Fe,“除钴”中Fe发生反应的离子方程式是__________________________________。
(3)“除铁”操作中加入H2O2的目的是______________________________,加入ZnO的目的是调节溶液pH,以除去溶液中的铁元素,调节溶液pH的范围为_________,“除铁”操作中的沉淀成分是__________(写化学式)。
(4)“电解”操作中,Cd2+在________极放电得到金属Cd,电极反应式是________________________。
(5)“电解”后的电解废液是ZnSO4溶液,用该电解废液制备ZnSO4·7H2O的方法是__________________。
(6)“除钴”后的含钴废渣在空气中煅烧,煅烧后的成分测定如表:
元素 | Co | Zn | Cu | Fe |
含量/% | 59.00 | 0.52 | 0.20 | 13.16 |
则煅烧后所得固体混合物中,钴氧化物的化学式是________。