题目内容
【题目】某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则这两种烃分别是( )
A. CH4 C5H12 B. C2H6 C4H8 C. CH4 C4H8 D. C2H2 C4H10
【答案】C
【解析】因为在同温同压下, 混合气体对氢气的相对密度为13,可以知道混合气体的平均相对分子质量为13![]() =26。在混合气体中肯定有相对分子质量小于26的物质的烃CH4,所以一定有CH4存在。混合烃总物质的量为:56L/22.4L.mol-1=2.5mol,混合烃总质量为m(混合烃)= 56L/22.4L.mol-1
=26。在混合气体中肯定有相对分子质量小于26的物质的烃CH4,所以一定有CH4存在。混合烃总物质的量为:56L/22.4L.mol-1=2.5mol,混合烃总质量为m(混合烃)= 56L/22.4L.mol-1![]() 26g/mol=65g。设烯烃的分子式为CnH2n,则有m(CnH2n)=35g, m(CH4)=30g,甲烷的物质的量为n(CH4)=30g/16 g/mol=1.875mol, n(CnH2n)= 2.5mol-1.875mol=0.625 mol
26g/mol=65g。设烯烃的分子式为CnH2n,则有m(CnH2n)=35g, m(CH4)=30g,甲烷的物质的量为n(CH4)=30g/16 g/mol=1.875mol, n(CnH2n)= 2.5mol-1.875mol=0.625 mol

【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下: 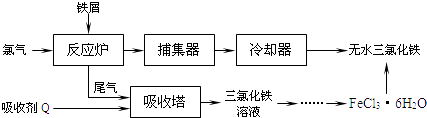
(1)试写出吸收塔中反应的离子方程式: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39).
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c molL﹣1 Na2S2O3溶液滴定用去V mL.(已知:I2+2S2O32﹣═2I﹣+S4O62﹣) ①滴定终点的现象是: .
②求样品中氯化铁的质量分数(写出计算过程) .