题目内容
【题目】下列图示与对应的叙述相符的是( )
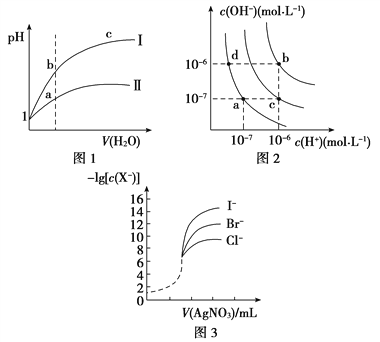
A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2中纯水仅升高温度,就可以从a点变到c点
C. 图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
D. 用0.010 0 mol/L硝酸银标准溶液,滴定浓度均为0.100 0 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
【答案】C
【解析】试题分析:A.盐酸是强酸,完全电离,醋酸是弱酸,部分电离,当开始时二者的pH相同,溶液中c(H+)相等,随着加水稀释,醋酸的电离平衡正向移动,使稀释过程中醋酸溶液中c(H+)大于盐酸,所以稀释相同倍数时盐酸的pH变化较大,醋酸的pH变化较小,溶液中离子浓度越大,溶液的导电性就越强,因此反应图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为醋酸,且a点溶液的导电性比b点强,错误;B.水的电离过程是吸热过程,升高温度,促进水的电离,水电离产生的c(H+)、c(OH-)都增大,若是纯水仅升高温度,就可以从a点变到b点,而若从a点变为c点,则还要加入强酸,不是仅升高温度实现,错误;C.图2中在b点对应温度下,Kw=1.0×10-12;将pH=2的H2SO4,c(H+)=10-2mol/L与pH=10的NaOH溶液,c(OH-)=10-2mol/L,二者等体积混合后,则溶液中c酸·V酸=c碱·V碱,n(H+)=n(OH-)所以溶液显中性,正确;D.根据图示可知,AgCl的溶解度最大,AgI的溶解度最小,所以用0. 0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,可确定首先沉淀的是I-,错误。