题目内容
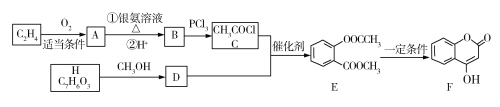
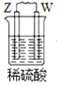
【题目】关于如图所示的原电池,下列说法正确的是( )
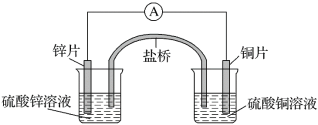
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.铜电极发生氧化反应,其电极反应是2H++2e-=H2↑
D.取出盐桥后,电流表仍会偏转,锌电极在反应后质量减少
【答案】A
【解析】
原电池中,较活泼金属作负极,![]() 作负极,失去电子,发生氧化反应,
作负极,失去电子,发生氧化反应,![]() 作正极,得到电子,发生还原反应,负极电极反应为:
作正极,得到电子,发生还原反应,负极电极反应为:![]() ,正极电极反应为:
,正极电极反应为:![]() ,电子从负极沿导线流向正极,盐桥中阳离子向正极移动,阴离子向负极移动。
,电子从负极沿导线流向正极,盐桥中阳离子向正极移动,阴离子向负极移动。
A. ![]() 作负极,
作负极,![]() 作正极,电子从锌电极通过电流表流向铜电极,A正确;
作正极,电子从锌电极通过电流表流向铜电极,A正确;
B. 盐桥中阳离子向正极移动,阴离子向负极移动,所以盐桥中的阴离子向硫酸锌溶液中迁移,B错误;
C. ![]() 作正极,发生还原反应,电极反应为:
作正极,发生还原反应,电极反应为:![]() ,C错误;
,C错误;
D. 取出盐桥后,不是闭合回路,没有电流产生,电流表不会偏转,D错误。

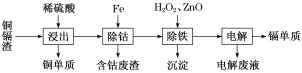
【题目】湿法炼锌产生的铜镉渣主要含锌、镉(Cd)、铜、铁、钴(Co)等金属单质。利用铜镉渣可生产Cu、Cd及ZnSO4·7H2O 等,其生产流程如图:
如表是部分金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.9 | 7.0 | 7.2 | 5.4 |
沉淀完全的pH | 3.2 | 9.0 | 9.5 | 8.2 |
请回答下列问题:
(1)提高铜镉渣的“浸出”速率的措施有________________________________(写出1条即可)。
(2)Fe的金属性比Co强,该流程中“除钴”________(填“能”或“不能”)用Zn代替Fe,“除钴”中Fe发生反应的离子方程式是__________________________________。
(3)“除铁”操作中加入H2O2的目的是______________________________,加入ZnO的目的是调节溶液pH,以除去溶液中的铁元素,调节溶液pH的范围为_________,“除铁”操作中的沉淀成分是__________(写化学式)。
(4)“电解”操作中,Cd2+在________极放电得到金属Cd,电极反应式是________________________。
(5)“电解”后的电解废液是ZnSO4溶液,用该电解废液制备ZnSO4·7H2O的方法是__________________。
(6)“除钴”后的含钴废渣在空气中煅烧,煅烧后的成分测定如表:
元素 | Co | Zn | Cu | Fe |
含量/% | 59.00 | 0.52 | 0.20 | 13.16 |
则煅烧后所得固体混合物中,钴氧化物的化学式是________。
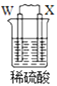
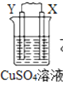
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y