题目内容
1.草酸铁晶体[Fe2(C2O4)3•5H2O]常用于制作催化剂和光敏材料.某校化学兴趣小组欲利用工业FeCl3制取纯净的草酸铁晶体.I.【查阅资料】
(1)异丙醚是微溶于水的液体,FeCl3在异丙醚中的溶解度比在水中大.
(2)草酸铁能溶于水和酸,不溶于醇和醚.
(3)FeCl3溶液和过量草酸钾(K2C2O4)溶液反应生成三草酸合铁酸钾(K3[Fe(C2O4)3]),配离子[Fe(C2O4)3]3-的配体是C2O42-,在含[Fe(C2O4)3]3-配离子的溶液中加入硫氰化钾溶液只看到很浅的红色.
Ⅱ.【制备产品】
实验步骤:
(1)将工业FeCl3溶于盐酸中,加适量水稀释,并分装入分液漏斗中.
盐酸的作用是:抑制FeCl3水解.
(2)继续向分液漏斗中加入适量异丙醚,充分振荡、静止,弃去水溶液.
(3)异丙醚溶液中加入草酸(H2C2O4)溶液,充分反应后分液,弃去醚层.
(4)水溶液通过蒸发、结晶、过滤、洗涤、干燥,得到草酸铁晶体.
洗涤草酸铁晶体时需用酒精溶液,其目的是除去杂质、减少草酸铁因溶解损耗.
Ⅲ【探究与反思】
某同学看到一则报道,环卫工人用草酸清除墙面上的铁锈.对此反应,该小组进行如下探究.
(1)提出假设:i.可能发生了氧化还原反应;ii.可能发生了复分解反应
(2)讨论分析:
结合上述实验,小组讨论后否定了假设i,其理由是由于Fe2(C2O4)3存在,不可能发生氧化还原反应;
请写出假设ii反应的化学方程式Fe2O3+3H2C2O4=Fe2(C2O4)3+3H2O.
通过查阅资料得知,在假设ii反应的基础上还进一步发生了反应,生成了[Fe(C2O4)3]3-配离子.
(3)设计实验:请利用制得的草酸铁晶体和下列药品,证明在假设ii反应的基础上还进一步发生了反应.
供选用的药品:KSCN溶液、0.1mol/L草酸钾溶液、草酸钾晶体,
取少量草酸铁晶体溶于水,取少量草酸铁晶体溶于水,滴入几滴KSCN溶液,溶液变红,将溶液分到2支试管中,一支试管中再加入过量的草酸钾晶体,充分振荡,观察到红色明显比另一支浅很多.
(4)反思总结:结合上面探究结论,常温下,为了提高草酸铁晶体的产率,制备实验中还应控制加入草酸的量(或氯化铁与草酸的比例).
分析 Ⅰ.配离子中由中心离子提供空轨道、配体提供孤电子对;
Ⅱ.(1)氯化铁溶液发生水解,结合平衡移动原理分析解答;
(4)题目信息中,草酸铁能溶于水和酸,不溶于醇和醚,洗涤应尽可能减少样品损失;
Ⅲ.(2)实验Ⅱ中FeCl3与H2C2O4溶液反应生成Fe2(C2O4)3;可知氧化铁与草酸反应生成Fe2(C2O4)3与水;
(3)利用KSCN溶液检验溶液中铁离子,再加入草酸,若生成了[Fe(C2O4)3]3-配离子,溶液颜色变浅,然后对比颜色变化;
(4)应避免生成[Fe(C2O4)3]3-配离子,需要控制加入草酸的量.
解答 解:Ⅰ.Fe3+离子含有空轨道,C2O42-离子有孤电子对,故配体为:C2O42-,
故答案为:C2O42-;
Ⅱ.(1)由于氯化铁溶液发生水解,将氯化铁溶解在盐酸中,可以抑制FeCl3水解,
故答案为:抑制FeCl3水解;
(4)题目信息中,草酸铁能溶于水和酸,不溶于醇和醚,用酒精洗涤除去杂质、减少草酸铁因溶解损耗,
故答案为:除去杂质、减少草酸铁因溶解损耗;
Ⅲ.(2)实验Ⅱ中FeCl3与H2C2O4溶液反应生成Fe2(C2O4)3,不可能发生氧化还原反应,假设i是错误的;可知氧化铁与草酸反应生成Fe2(C2O4)3与水,反应方程式为:Fe2O3+3H2C2O4=Fe2(C2O4)3+3H2O,
故答案为:由于Fe2(C2O4)3存在,不可能发生氧化还原反应;Fe2O3+3H2C2O4=Fe2(C2O4)3+3H2O;
(3)利用KSCN溶液检验溶液中铁离子,再加入草酸,对比颜色变化,具体方案为:取少量草酸铁晶体溶于水,滴入几滴KSCN溶液,溶液变红,将溶液分到2支试管中,一支试管中再加入过量的草酸钾晶体,充分振荡,观察到红色明显比另一支浅很多,
故答案为:取少量草酸铁晶体溶于水,滴入几滴KSCN溶液,溶液变红,将溶液分到2支试管中,一支试管中再加入过量的草酸钾晶体,充分振荡,观察到红色明显比另一支浅很多;
(4)应避免生成[Fe(C2O4)3]3-配离子,需要控制加入草酸的量或控制氯化铁与草酸的比例,
故答案为:加入草酸的量(或氯化铁与草酸的比例).
点评 本题考查实验制备与探究,是对学生综合能力的考查,注意对题目信息的运用,难度中等,注意操作的规范性及实验现象、实验原理.

 发散思维新课堂系列答案
发散思维新课堂系列答案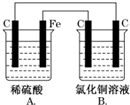 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )| A. | A烧杯中电解质溶液pH变大 | |
| B. | B烧杯中阳离子从左向右移动 | |
| C. | 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体为0.1 mol | |
| D. | 一段时间后,B烧杯中溶液的浓度减小 |
| A. | H+、Fe2+、NO3-、SO42- | B. | Na+、H+、AlO2-、HCO3- | ||
| C. | Ca2+、Fe3+、CO32-、CH3COO- | D. | Ca2+、Na+、HCO3-、Cl- |
| A. | K+、Na+、NO3-、CO32-在碱性溶液中能大量共存 | |
| B. | Na+ K+ OH- Cl-在强酸性溶液中能大量共存 | |
| C. | Cu2+、H+、NO3-、SO42-能形成无色透明的溶液 | |
| D. | Ba2+、Na+、Cl-、SO42-在溶液中不能大量共存 |
| A. | 氯化钠溶液中滴入硝酸银溶液 | B. | 金属钠在氯气中燃烧生成氯化钠 | ||
| C. | 铁片置于硫酸铜溶液中 | D. | 氢氧化钠溶液与稀硫酸反应 |
| A. | ①②⑤ | B. | ①②④ | C. | ②③④ | D. | ③④⑤ |
| A. | 绿色植物光合作用过程中是由太阳能转变成化学能 | |
| B. | 研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放 | |
| C. | 煤、石油、天然气属于可再生能源 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
