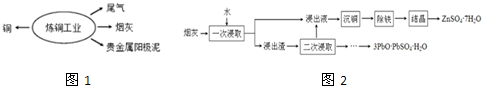
题目内容
13.(1)下列过程中不一定放出能量的是C.A.形成化学键 B.燃料燃烧 C.化合反应 D.葡萄糖在体内的氧化分解
E.酸碱中和 F.炸药爆炸
(2)已知A和B是同种元素形成的两种单质,A转化为B时需吸收能量,则A和B相比较,稳定的是A(填“A”或“B”).
(3)等质量的下列物质分别完全燃烧,放出热量较多的是B.
A.固体硫 B.硫蒸气
(4)已知H2和O2反应放热,且破坏1mol H-H键、1mol O=O键、1mol O-H键需吸收的能量分别为Q1kJ、Q2kJ、Q3kJ.下列关系正确的是C.
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.2Q1+Q2<4Q3 D.2Q1+Q2<2Q3.
分析 (1)有些化合反应是吸热反应,如碳和二氧化碳反应制一氧化碳,其它反应都是放热反应;
(2)物质含有的能量越高,物质的稳定性越差,根据A与B的转化过程中能量变化比较二者的稳定性;
(3)固体硫变为硫蒸气需吸收热量,所以等量的S燃烧时,硫蒸气放出热量更多;
(4)破坏2 mol H2和1 mol O2需要吸收的热量为2×Q1kJ+Q2kJ=(2Q1+Q2) kJ,生成2 mol H2O释放的热量为4×Q3kJ=4Q3 kJ,由于反应放热,据此进行判断.
解答 解:(1)形成化学键、燃料的燃烧、葡萄糖在体内的氧化分解、酸碱中和反应和炸药的爆炸过程都属于放热反应,而化合反应不一定为放热反应,如二氧化碳与C的反应属于吸热反应,所以不一定释放能量的为C,
故答案为:C;
(2)A和B是同种元素的两种单质,A转化为B时需吸收能量,说明B的能量高于A,所以稳定性A的强于B,
故答案为:A;
(3)固体硫变为硫蒸气需吸收热量,所以等量的S燃烧时,硫蒸气放出热量更多,故选:B;
(4)破坏2 mol H2和1 mol O2需要吸收的热量为2×Q1kJ+Q2kJ=(2Q1+Q2) kJ,生成2 mol H2O释放的热量为4×Q3kJ=4Q3 kJ,由于反应放热,则有放出的热量大于吸收的热量,即2Q1+Q2<4Q3,故答案为:C.
点评 本题考查了化学反应与能量变化等,题目难度中等,注意掌握吸热反应与放热反应的概念,(2)为易错点,注意物质稳定性与物质能量大小之间关系.

练习册系列答案
相关题目
18.常温下,碱性溶液中,可能大量共存的离子组是( )
| A. | K+、CO32-、Cl-、NO3- | B. | K+、Fe2+、I-、SO42- | ||
| C. | Ba2+、Na+、Cl-、NO3- | D. | Na+、Ca2+、Al3+、Cl- |
2. 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$;△H<0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008 mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
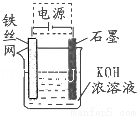
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008 mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
 .
.