题目内容
7.常温下,下列各组离子能大量共存的是( )| A. | H+、Fe2+、NO3-、SO42- | B. | Na+、H+、AlO2-、HCO3- | ||
| C. | Ca2+、Fe3+、CO32-、CH3COO- | D. | Ca2+、Na+、HCO3-、Cl- |
分析 根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,不能相互促进水解等,则离子大量共存,以此来解答.
解答 解:A.H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故A错误;
B.H+、AlO2-结合生成沉淀,H+、HCO3-结合生成水和气体,AlO2-促进HCO3-的电离,不能大量共存,故B错误;
C.Fe3+分别与CO32-、CH3COO-相互促进水解,Ca2+、CO32-结合生成沉淀,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应及复分解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
18.常温下,碱性溶液中,可能大量共存的离子组是( )
| A. | K+、CO32-、Cl-、NO3- | B. | K+、Fe2+、I-、SO42- | ||
| C. | Ba2+、Na+、Cl-、NO3- | D. | Na+、Ca2+、Al3+、Cl- |
15.配制250mL 2mol/L的稀盐酸,需要12.5mol/L的浓盐酸的体积为( )
| A. | 20mL | B. | 40mL | C. | 60mL | D. | 80mL |
2.下列反应属于氧化还原反应的是( )
| A. | 2NaHCO3═Na2CO3+CO2↑+H2O | B. | MnO2+4 HCl(浓)═MnCl2+Cl2↑+2 H2O | ||
| C. | 2 H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2 H2O+O2↑ | D. | Na2CO3+CaCl2═CaCO3↓+2NaCl |
2. 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$;△H<0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008 mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
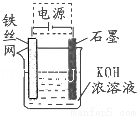
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008 mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
