题目内容
6.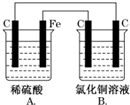 烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
烧杯A中盛放0.1mol•L-1的H2SO4溶液,烧杯B中盛放0.1mol•L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )| A. | A烧杯中电解质溶液pH变大 | |
| B. | B烧杯中阳离子从左向右移动 | |
| C. | 当A烧杯中产生0.1 mol气体时,B烧杯中产生气体为0.1 mol | |
| D. | 一段时间后,B烧杯中溶液的浓度减小 |
分析 A、A中Fe、C、稀硫酸构成原电池,为析氢腐蚀;
B、B为电解池,阳离子向阴极移动;
C、根据电极方程式结合电子守恒分析;
D、B中电解氯化铜,溶液的浓度减小.
解答 解:A、A中Fe、C、稀硫酸构成原电池,为铁的析氢腐蚀,所以电解质溶液pH变大,故A正确;
B、A、B相连,B有外接电源,所以B为电解池,并且与铁相连的左边碳为阴极,所以阳离子从右向左移动,故B错误;
C、A中C上有氢气生成,其电极反应式为:2H++2e-=H2↑,当A烧杯中产生0.1mol气体时,转移0.2mol电子,B中阳极上氯离子失电子生成氯气,其电极反应式为:2Cl--2e-=Cl2↑,当转移0.2mol电子时,生成氯气为0.1mol,故C正确;
D、B中为惰性电极电解电解氯化铜,所以一段时间后,B烧杯中溶液的浓度会减小,故D正确;
故选B.
点评 本题考查了原电池原理和电解池原理的应用,注意根据电池中转移的电子守恒来计算生成的气体的物质的量,题目难度不大.

练习册系列答案
相关题目
16.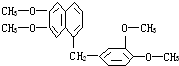 鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )
鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )
 鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )
鸦片具有复杂的组成,其中所含罂粟碱分子结构如图,由其分子结构可推知下列关于罂粟碱的叙述中错误的是( )| A. | 其分子式为C21H22O4 | |
| B. | 罂粟碱属芳香酯类 | |
| C. | 1 mol罂粟碱完全燃烧需O2量24.5 mol | |
| D. | 其苯环氢的一溴取代物可有8种结构 |
18.常温下,碱性溶液中,可能大量共存的离子组是( )
| A. | K+、CO32-、Cl-、NO3- | B. | K+、Fe2+、I-、SO42- | ||
| C. | Ba2+、Na+、Cl-、NO3- | D. | Na+、Ca2+、Al3+、Cl- |
15.配制250mL 2mol/L的稀盐酸,需要12.5mol/L的浓盐酸的体积为( )
| A. | 20mL | B. | 40mL | C. | 60mL | D. | 80mL |
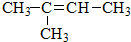
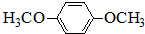
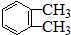
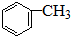
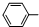 )
)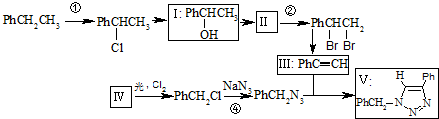
 (不要求写出反应条件).
(不要求写出反应条件).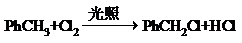 (要求写出反应条件).
(要求写出反应条件).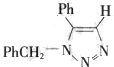 .
.