题目内容
6.某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32-、SiO32-、SO42-、C1-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
已知:B溶液中含有Fe3+.
(1)沉淀C的化学式是BaSO4溶液E中的溶质是HNO3
(2)①中发生反应产生气体的离子方程式为:3Fe2++NO3-+4 H+=3Fe3++NO↑+2H2O
(3)下列说法正确的是AB
A.D是红棕色有毒气体
B.X中肯定存在Fe2+、A13+、NH4+、SO42-
C.溶液E和气体F不能发生化学反应
D.X中不能确定是否存在的离子是 A13+和Cl-
(4)如果②中通入过量的CO2,则生成沉淀I的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
分析 强酸性溶液中一定不会存在CO32-和SiO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,不能确定是否含有的离子为Cl-,以此来解答.
解答 解:(1)氢离子和碳酸根离子反应生成水和二氧化碳、氢离子和硅酸根离子反应生成硅酸沉淀,所以强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4沉淀,SO42-+Ba2+=BaSO4↓,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,
故答案为:BaSO4;HNO3;
(2)A为NO,生成A的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)A.D为NO2,NO2是红棕色有毒气体,故A正确;
B.X中肯定存在Fe2+、A13+、NH4+、SO42-,不能确定是否含有的离子为Cl-,故B正确;
C.溶液E为HNO3,气体F为NH3,硝酸和氨气发生化学反应生成硝酸铵,故C错误;
D.X中一定含有A13+,不能确定是否存在的离子是Cl-,故D错误;
故答案为:AB;
(4)溶液H中溶于CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,如果②中通入过量的CO2,则生成沉淀I的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
点评 本题考查离子的检验及推断,为高频考点,把握离子之间的反应,转化中气体A、F为解答的关键,侧重分析与推断能力的综合考查,题目难度中等.

| A. | 64 | B. | 48 | C. | 32 | D. | 16 |
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2NaOH H2SO4 | D. | NH4Cl H2O CO2 |
| A. | 乙酸根离子的结构式: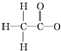 | |
| B. | CO2分子的球棍模型: | |
| C. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| D. | 醛基的电子式为 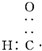 |
 )
)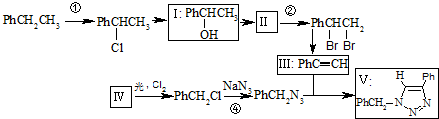
 (不要求写出反应条件).
(不要求写出反应条件).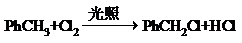 (要求写出反应条件).
(要求写出反应条件).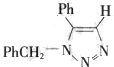 .
.
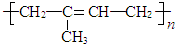 .
.