题目内容
1.能源是现代社会发展的三大支柱之一.化学在提高能源的利用率和开发新能源中起到了重要的作用.(1)电能是现代社会中应用最广泛的二次能源,下列装置中(如图)能够实现化学能转化为电能的是C(填序号).写出该装置总反应的离子方程式2H++Zn=Zn2++H2↑,负极反应的电极反应式Zn-2e-=Zn2+正极反应的电极反应式2H++2e-=H2↑.该装置中溶液里的阴离子移向Zn(填电极的化学式)极;若装置中转移了0.2mol电子,则理论上整体质量增重6.3g.

(2)能否根据反应NaOH+HCl=NaCl+H2O设计原电池,否(填“能”或“否”),原因是没有电子转移,不属于氧化还原反应.
分析 (1)原电池能够实现化学能转化为电能,根据构成原电池的条件:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应分析;
(2)能设计呈原电池的反应必须为氧化还原反应.
解答 解:(1)原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,
A.无水乙醇为非电解质,该装置不能自发的进行氧化还原反应,所以不能形成原电池,故A错误;
B.该装置中电极材料相同,所以不能形成原电池,故B错误;
C.该装置符合构成原电池的条件,故C正确;
D.该装置不能构成闭合回路,所以不能形成原电池,故D错误;
C装置中Ag作正极,正极上氢离子得电子生成氢气,其电极反应为:2H++2e-=H2↑,负极为锌失电子生成锌离子,反应式为Zn-2e-=Zn2+;总反应为:2H++Zn=Zn2++H2↑;阴离子移向负极锌;装置中转移了0.2mol电子,根据总反应为:2H++Zn=Zn2++H2↑,则理论上整体质量增重0.1×65-0.1×2=6.3g.
故答案为:C;2H++Zn=Zn2++H2↑;Zn-2e-=Zn2+;2H++2e-=H2↑;Zn;6.3g;
(2)自发进行的放热的氧化还原反应能设计成原电池,NaOH+HCl=NaCl+H2O反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池,
故答案为:否;没有电子转移,不属于氧化还原反应.
点评 本题考查了原电池原理的应用、化学方程式的书写等,为高频考点,注意把握原电池的正负极的判断及电极反应方程式的书写方法是解决本题的关键,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
18.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示.
试回答:①实验1、2研究的是温度对H2O2分解速率的影响.
②实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对双氧水分解反应速率影响的差异
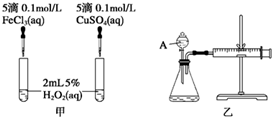
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除阴离子的干扰.
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验.完成该实验应该测定的实验数据是测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间).
实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂是合理的是B
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰.
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示.
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
②实验2、3的目的是比较FeCl3溶液和MnO2作为催化剂对双氧水分解反应速率影响的差异
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
①定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除阴离子的干扰.
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验.完成该实验应该测定的实验数据是测定一定时间内产生的气体(或测定产生一定体积的气体所需的时间).

实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂是合理的是B
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰.
9.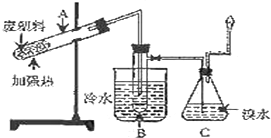 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
(1)废塑料充分加热后,试管A中的残余物有多种用途,如可通过下列转化制取高聚物聚乙炔:
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为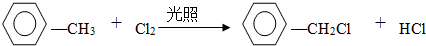 .
.
(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
 某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.
某研究小组探究将废塑料隔绝空气加强热使其变成有用的物质,实验装置如图.该研究小组在实验中测得加热聚丙烯废塑料所得的产物如下表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
A中残留物$\stackrel{①}{→}$电石$\stackrel{②}{→}$乙炔$\stackrel{③}{→}$聚乙炔该转化流程中,第②步反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑.
(2)试管B中收集到油状液体,其中的一种成分D能使酸性高锰酸钾溶液褪色.D与氯气在光照条件下生成一氯取代物的化学方程式为
 .
.(3)锥形瓶C中的现象是有气泡,溶液颜色渐渐褪去,气体经过锥形瓶C中的溴水充分吸收后再经干燥,所得气体的平均相对分子质量为4.8.
(4)C中逸出的气体在工业上可用作(至少两点)可做燃料、做化工生产原料.
10.某原电池装置如图所示.下列有关叙述中,正确的是( )
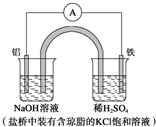

| A. | Fe作正极,发生氧化反应 | |
| B. | 负极反应:Al-3e-+3OH-═Al(OH)3↓ | |
| C. | 工作一段时间后,盛有稀硫酸溶液的杯中pH不变 | |
| D. | 盐桥中的Cl-向左边烧杯中移动,使该烧杯中溶液保持电中性 |
 请按要求回答下列问题:
请按要求回答下列问题: 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O. +2nH2O.
+2nH2O.