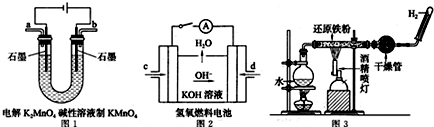
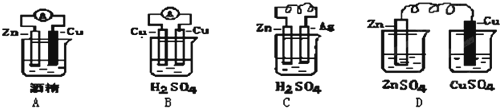
题目内容
16.(1)室温下,如果将0.1molCH3COONa和0.05molHCl全部溶于水,形成混合溶液(假设无损失),CH3COOH和CH3COO-两种粒子的物质的量之和等于0.1mol.(2)已知某溶液中只有Na+、CH3COO-、H+、OH-四种离子.某同学推测该溶液中离子浓度可能有如下四种关系:
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
①若溶液中只溶解了一种溶质,该溶质的名称是醋酸钠,上述离子浓度大小关系中正确的是(填序号)A;
②若上述关系中D是正确的,则溶液中溶质的化学式是CH3COONa和CH3COOH;
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,则混合前c(CH3COOH)(填“>”“<”“=”,下同)>c(NaOH),混合后c(CH3COO-)与c(Na+)的关系是c(CH3COO-)= c(Na+).
(3)25℃时,向0.1mol/L的醋酸溶液中加入少量的醋酸钠固体,当固体溶解后,测得溶液的pH增大,主要原因是C(填序号)
A.醋酸与醋酸钠发生反应
B.醋酸钠溶液水解显碱性,增加了c(OH-)
C.醋酸钠溶于水电离出醋酸根离子,抑制了醋酸的电离,使c(OH-)减小.
分析 (1)室温下,如果将0.1molCH3COONa和0.05molHCl全部溶于水,形成混合溶液(假设无损失),溶液中的溶质是0.05mol的NaCl、0.05mol的CH3COONa、0.05molCH3COOH;
(2)①若溶液中只溶解了一种溶质,则只能是醋酸钠,其溶液呈碱性;
②溶液中的溶质是醋酸钠和醋酸;
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,醋酸应该应该稍微过量,根据溶液酸碱性确定c(CH3COO-)、c(Na+)相对大小;
(3)25℃时,向0.1mol/L的醋酸溶液中加入少量的醋酸钠固体,当固体溶解后,测得溶液的pH增大,醋酸根离子增大抑制醋酸电离.
解答 解:(1)常温下,如果将0.1molCH3COONa和0.05molHCl全部溶于水,形成混合溶液(假设无损失),溶液中的溶质是0.05mol的NaCl、0.05mol的CH3COONa、0.05molCH3COOH,根据物料守恒得n(CH3COOH)+n(CH3COO-)=0.1mol,
故答案为:CH3COOH,CH3COO-;
(2)①若溶液中只溶解了一种溶质,水中含有氢离子和氢氧根离子,则溶质应该是醋酸钠,所以该溶质的名称是醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,所以c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO-),醋酸根离子水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:醋酸钠;A;
②若上述关系中D是正确的,溶液呈酸性,醋酸钠呈碱性,则溶液中的溶质是CH3COONa和CH3COOH,故答案为:CH3COONa和CH3COOH;
③若该溶液由体积相等的醋酸与NaOH溶液混合而成,且溶液恰好呈中性,醋酸钠溶液呈碱性,要使混合溶液呈中性,且二者体积相等,则混合前c(CH3COOH)>c(NaOH),溶液呈中性c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(Na+),
故答案为:>;=;
(3)25℃时,向0.1mol/L的醋酸溶液中加入少量的醋酸钠固体,当固体溶解后,测得溶液的pH增大,醋酸钠溶解导致溶液中醋酸根离子浓度,抑制醋酸电离,溶液中氢离子浓度减小,则氢氧根离子浓度增大,故选C.
点评 本题考查了弱电解质的电离、盐类水解等知识点,根据溶液中的溶质及其性质来分析解答,再结合电荷守恒、物料守恒来分析,难点是判断(2)中溶液中的溶质,题目难度中等.

 阅读快车系列答案
阅读快车系列答案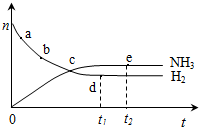 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
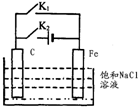
| A. | 断开 K2,闭合 K1时,Fe 电极反应为:2 H++2e-=H2↑ | |
| B. | 断开 K2,闭合 Kl 时,C电极反应为:2Cl--2e-=Cl2↑ | |
| C. | 断开 K1,闭合 K2时,Fe 电极反应为:Fe-2e-=Fe2+ | |
| D. | 断开 Kl,闭合 K2时,C电极反应为:2Cl--2e-=Cl2↑ |