题目内容
11.下列物质不属于电解质,但其水溶液能导电的是( )| A. | HCl | B. | BaCO3 | C. | NaCl | D. | SO3 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答 解:A、HCl为强酸,溶于水能导电,属于强电解质,故A错误;
B、碳酸钡属于盐,熔融状态下能导电,属于强电解质,故B错误;
C、氯化钠为盐,溶于水合熔融状态下均能导电,属于强电解质,故C错误;
D、三氧化硫不能导电,但是溶于水后与水反应生成硫酸,硫酸为电解质,能导电,故D正确,故选D.
点评 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.

练习册系列答案
相关题目
1.基态原子的核外电子排布的原则不包括( )
| A. | 能量最低原则 | B. | 能量守恒原理 | C. | 泡利不相容原理 | D. | 洪特规则 |
2. 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )| A. | NaNO2在水中的溶解性大于NH4NO2 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI、淀粉和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2 转移6 mol e- |
19.工业上制备纯硅反应是SiCl4(g)+2H2(g)?Si(s)+4HCl(g);△H=+QkJ•mol-1(Q>0).某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
| A. | 反应过程中,若降低压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则平衡时,吸收热量为QkJ | |
| C. | 将反应的温度由T1升高至T2,则反应的平衡常数K1>K2 | |
| D. | 当反应吸收热量为0.25QkJ时,生成的HCl恰好能与1 molNaOH反应 |
6.“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用.下列化学反应中,不符合绿色化学概念的是( )
| A. | 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3 | |
| B. | 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O | |
| C. | 制硫酸铜:Cu+2H2SO4=CuSO4+SO2↑+2H2O | |
| D. | 制硫酸铜:2Cu+O2=2CuO CuO+H2SO4(稀)=CuSO4+H2O |
16.在下列溶液中,能大量共存的离子组是( )
| A. | 能使pH试纸显蓝色的溶液中:K+、Ba2+、H+、Br- | |
| B. | 加入Al能放出H2的溶液中:K+、Na+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 能使石蕊试液显红色的溶液中:K+、SO42-、S2-、CO32- |
4.CoCl2•6H2O是制备钴酸锂电池用四氧化三钴粉末的主要原料,工业上利用水钴矿(主要成分为Co2O3、Fe2O3、FeO、Al2O3等)制取CoCl2•6H2O的简化工艺流程如图所示:

(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
步骤3中加入Na2CO3目的是除去铁和铝元素,其之所以可以除去铁和铝元素的原因是CO32-与H+反应消耗H+,促使Fe3+、Al3+水解平衡右移,生成Fe(OH)3、Al(OH)3沉淀而将其除去.理论上,此步pH应该控制的范围是5.4≤PH<7.6.
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.

(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.
5.下列有关化学反应表达正确的是( )
| A. | 服用阿司匹林过量出现水杨酸(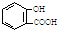 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: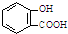 +2HCO3-→ +2HCO3-→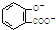 +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| B. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |