题目内容
16.氧化亚铜是大型水面舰艇防护涂层的重要原料.某小组通过查阅资料,进行如下研究.资料:1.氧化亚铜:化学式Cu2O,红色至红褐色结晶或粉末,不溶于水及有机溶剂,可溶于稀盐酸、稀硫酸等,在稀硫酸溶液中歧化为二价铜和铜单质.氧化亚铜在1800℃时分解,在干燥空气中稳定,但在潮湿空气中被慢慢氧化为氧化铜.氧化亚铜主要用于制造船底防污漆、杀虫剂…2.葡萄糖还原法制备氧化亚铜:将葡萄糖与新制氢氧化铜悬浊液混合后进行反应,生成氧化亚铜,条件控制不当时会有少量氧化铜生成.
I.Cu2O的制取
(1)葡萄糖还原法制Cu2O的化学方程式为
 .
.(2)实验室用此方法制取并获得少量Cu2O固体,需要的玻璃仪器除试管、酒精灯、烧杯外,还需要漏斗、玻璃棒.
II.检验样品中是否含有CuO
方案1:将制得的Cu2O样品溶于足量稀硫酸.
(3)甲同学认为若溶液变为蓝色,则说明样品中含有CuO杂质.乙同学认为此推论不合理,用化学用语解释原因Cu2O+H2SO4=CuSO4+Cu+H2O.
(4)甲同学通过反思,认为将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是Cu2O样品的质量、反应后剩余固体(Cu)的质量.
方案2:丙同学认为采用如下装置(所加药品均足量)进行实验,通过测定c装置反应后固体的质量以及d装置反应前后增重的质量,可计算,从而确定样品中是否含有氧化铜.
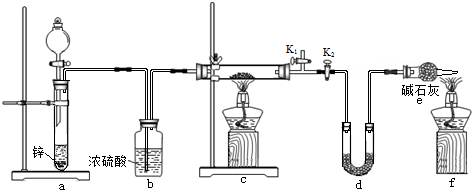
(5)装置a中所加的酸是H2SO4(填化学式),装置e中碱石灰的作用是防止空气中的水进入d装置,m(H2O)测定不准确.
(6)点燃装置c中酒精灯之前需进行的操作是打开K1,关闭K2,通一段时间氢气后验纯,再打开K2,关闭K1.
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是防止生成的Cu单质在高温下又被氧气氧化为CuO,导致测定数据不准确.
分析 Ⅰ.(1)葡萄糖还原法制Cu2O是利用葡萄糖中醛基被氢氧化铜氧化,反应生成葡萄糖酸、氧化亚铜和水,制取氢氧化铜可用可溶性铜盐和强碱反应,反应得到的葡萄糖酸与碱反应生成盐;
(2)葡萄糖与新制氢氧化铜反应需要加热,生成氧化亚铜沉淀,需要经过过滤操作进行分离;
Ⅱ.方案1:(3)氧化亚铜也和硫酸发生氧化还原反应生成硫酸铜,溶液显蓝色,同时生成Cu单质;
(4)将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是氧化亚铜样品质量和反应生成铜的质量,通过化学方程式计算分析;
方案2:a装置产生氢气,b装置干燥氢气,c装置中氢气与铜的氧化物反应置换出Cu,d装置吸收水,可以测定生成水的质量,装置e中碱石灰的作用是防止空气中的水进入d装置,影响水质量测定;
(5)a装置产生氢气,应防止酸的挥发,应选用难挥发性的酸;
(6)点燃装置c中酒精灯之前需检验氢气的纯度;
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却是防止空气进入氧化生成的铜,测定结果产生误差.
解答 解:Ⅰ.(1)葡萄糖还原法制Cu2O是利用葡萄糖中醛基被氢氧化铜氧化,反应生成葡萄糖酸、氧化亚铜和水,制取氢氧化铜可用可溶性铜盐和强碱反应,反应得到的葡萄糖酸与碱反应生成盐,葡萄糖还原法制Cu2O的化学方程式为: ,
,
故答案为: ;
;
(2)葡萄糖与新制氢氧化铜反应需要加热,故所需玻璃仪器为试管、酒精灯,分离生成的氧化亚铜沉淀,需要进行过滤操作,所需玻璃仪器为漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒;
Ⅱ.方案1:(3)氧化亚铜也和硫酸发生氧化还原反应生成硫酸铜,溶液显蓝色,同时生成Cu单质,反应的化学方程式为:Cu2O+H2SO4=CuSO4+Cu+H2O,
故答案为:Cu2O+H2SO4=CuSO4+Cu+H2O;
(4)将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是Cu2O样品的质量、反应后剩余固体(Cu)的质量;
故答案为:Cu2O样品的质量、反应后剩余固体(Cu)的质量;
方案2:a装置产生氢气,b装置干燥氢气,c装置中氢气与铜的氧化物反应置换出Cu,d装置吸收水,可以测定生成水的质量,装置e中碱石灰的作用是防止空气中的水进入d装置,影响水质量测定;
(5)d装置中的碱石灰会吸收水和酸性气体,防止a中酸挥发,故选难挥发性酸硫酸,装置e中碱石灰的作用是防止空气中的水进入d装置,m(H2O)测定不准确;
故答案为:H2SO4;防止空气中的水进入d装置,m(H2O)测定不准确;
(6)点燃装置c中酒精灯之前需检验氢气的纯度,验纯后应保持气体能通过d装置,使生成的水全部被d装置吸收,具体操作:打开K1,关闭K2,通一段时间氢气后验纯,再打开K2,关闭K1,
故答案为:打开K1,关闭K2,通一段时间氢气后验纯,再打开K2,关闭K1;
(7)灼热的铜和氧气会发生反应生成氧化铜,所以熄灭酒精灯之后,仍需通一段时间H2至试管冷却是防止空气进入氧化生成的铜,测定结果产生误差;
故答案为:防止生成的Cu单质在高温下又被氧气氧化为CuO,导致测定数据不准确.
点评 本题考查实验制备方案,是对学生综合能力的考查,侧重考查学生对原理、装置分析评价,难度中等.

 阅读快车系列答案
阅读快车系列答案 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )
亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,其物理性质与NaCl极为相似.相关转化关系如图所示,下列说法不正确的是( )| A. | NaNO2在水中的溶解性大于NH4NO2 | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI、淀粉和食醋鉴别NaNO2和NaCl | |
| D. | 分解NaN3盐每产生1 mol N2 转移6 mol e- |

(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.
| A. | 硫原子的原子结构示意图: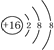 | |
| B. | 过氧化钠的电子式: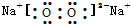 | |
| C. | 原子核内有8个质子、10个中子的氧原子:810O | |
| D. | HClO的结构式为 H-Cl-O |
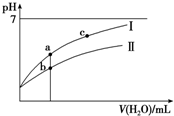 已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25°C时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
| B | 由溴丙烷水解制丙醇、由丙烯与水反应制丙醇 | 属于同一反应类型 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | C4H9Cl的同分异构体数目(不考虑立体异构) | 共有4种 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 服用阿司匹林过量出现水杨酸(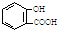 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: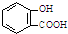 +2HCO3-→ +2HCO3-→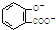 +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| B. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |