题目内容
2.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O的反应中,还原剂是HCl,还原产物是MnCl2,氧化产物与还原产物的物质的量之比为5:2,被氧化与未被氧化的HCl的质量之比为5:3,电子转移的总数为10e-,若有7.3gHCl被氧化,则产生Cl2标准状况下的体积为2.24L,转移的电子的物质的量为0.2mol.分析 2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移电子为10e-,以此来解答.
解答 解:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Cl元素的化合价升高,则HCl作还原剂,Mn元素的化合价降低被还原,对应产物MnCl2是还原产物;
氯气为氧化产物,则氧化产物与还原产物的物质的量之比为5:2;
在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,被氧化与未被氧化的HCl的质量之比为5:3;
由元素的化合价变化可知,该反应中转移电子总数为10e-;
若有7.3g即0.2molHCl被氧化,产生Cl2的物质的量为0.1mol,其体积为0.1mol×22.4L/mol=2.24L,转移的电子的物质的量为0.1mol×2=0.2mol;
故答案为:HCl;MnCl2;5:2;5:3;10e-;2.24;0.2mol.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析、应用及计算能力的考查,题目难度不大.

练习册系列答案
相关题目
10.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含Ba2+的数目为0.1NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 7.1g氯气与足量热烧碱溶液反应,转移电子数为0.1NA |
7.常温下,下列各组离子能大量共存的是( )
| A. | K+,Na+,Br-,Fe3+ | B. | H+,K+,MnO${\;}_{{4}^{\;}}$-,C2O42- | ||
| C. | K+,H+,NO3-,I- | D. | Na+,H+,SO32-,S2+ |
14.已知每个M2O7x-恰好能将3个S2-氧化为单质S,自身被还原为M3+,则M2O7x-离子中M的化合价是( )
| A. | +2价 | B. | +3价 | C. | +4价 | D. | +6价 |
11.下列变化过程中,画横线的元素被还原的是( )
| A. | CO2→CO | B. | FeCl2→FeCl3 | C. | HCl→AgCl | D. | KI→I2 |

 +2Na→
+2Na→ +H2↑
+H2↑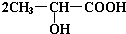 +Na2CO3→
+Na2CO3→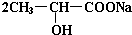 +H2O+CO2↑,
+H2O+CO2↑,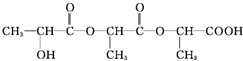

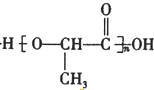
 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O. A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:
A,B,C,D,E是五种短周期元素,A,B,C,D,E分别代表元素符号,他们的原子序数依次增大,A是元素周期表中半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的$\frac{3}{4}$;C与E同主族.请回答下列问题:
 、
、 .
.