题目内容
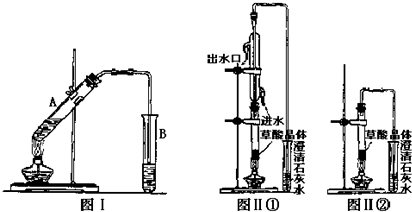
16.1,2-二溴丙烷可用于有机合成,也可作溶剂,常温下为无色液体,密度1.926g•cm-3,沸点140℃,熔点-55.2℃,不溶于水,可溶于乙醇、乙醚、丙酮、氯仿.在实验室中可用如图所示装置制备1,2-二溴丙烷.其中分液漏斗和烧瓶a中装有异丙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
(1)写出本题中制备1,2-二溴丙烷的两个化学反应方程式:
 、
、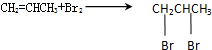 .
.(2)如何检验a、b装置的气密性?在b装置中加水,封住玻璃管下口,关闭分液漏斗旋塞和b、c之间的止水夹,微热圆底烧瓶,若水沿着b中的琉璃管上升,冷却至室温,水又回落至原来位置,则说明a、b装置的气密性良好.
(3)a装置中加入碎瓷片的作用是防暴沸,B装置玻璃管的作用安全装置,防堵塞.
(4)装置e中NaOH溶液的作用是吸收尾气,防止污染空气
(5)某同学在做此实验时使用一定量的液溴当溴全部褪色时,所消耗异丙醇和浓硫酸混合液的量比正常情况下多很多.若装置的气密性良好,试分析其可能的原因:产生丙烯速度过快,来不及和溴反应就排出了或副反应多,丙烯产量低或异丙醇挥发过多等.
分析 制备1,2-二溴丙烷,由实验装置可知,分液漏斗和烧瓶a中装有异丙醇和浓硫酸的混合液,加热时发生 ,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生
,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生 ,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,以此来解答;
,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,以此来解答;
解答 解:制备1,2-二溴丙烷,由实验装置可知,分液漏斗和烧瓶a中装有异丙醇和浓硫酸的混合液,加热时发生 ,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生
,浓硫酸在该反应中作催化剂、脱水剂、吸水性,b可防止倒吸,且可吸收异丙醇,c中NaOH溶液可除去丙烯中的酸性物质,d中发生 ,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,
,由信息可知,冷水冷却后试管中无色液体为1,2-二溴丙烷,e可吸收尾气中的溴,
(1)根据上面的分析可知,本题中制备1,2-二溴丙烷的两个化学反应方程式为 、
、 ,
,
故答案为: 、
、 ;
;
(2)检验a、b装置的气密性可以在b装置中加水,封住玻璃管下口,关闭分液漏斗旋塞和b、c之间的止水夹,微热圆底烧瓶,若水沿着b中的琉璃管上升,冷却至室温,水又回落至原来位置,则说明a、b装置的气密性良好,
故答案为:在b装置中加水,封住玻璃管下口,关闭分液漏斗旋塞和b、c之间的止水夹,微热圆底烧瓶,若水沿着b中的琉璃管上升,冷却至室温,水又回落至原来位置,则说明a、b装置的气密性良好;
(3)a装置中加入碎瓷片的作用是 防暴沸,根据上面的分析可知,B装置玻璃管的作用 安全装置,防堵塞,
故答案为:防暴沸; 安全装置,防堵塞;
(4)装置e中NaOH溶液的作用是吸收尾气,防止污染空气,
故答案为:吸收尾气,防止污染空气;
(5)当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多的原因可能是产生丙烯速度过快,来不及和溴反应就排出了或副反应多,丙烯产量低或异丙醇挥发过多等,
故答案为:产生丙烯速度过快,来不及和溴反应就排出了或副反应多,丙烯产量低或异丙醇挥发过多等.
点评 本题考查制备实验方案的设计,为高频考点,把握有机物的结构与性质、丙烯的制备实验、丙烯的化学性质及实验装置的作用为解答的关键,侧重分析与实验能力的综合考查,题目难度中等.

 名校课堂系列答案
名校课堂系列答案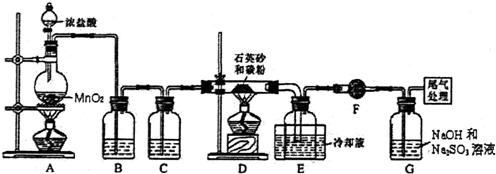
已知SiCl4的熔点为-70.0℃,沸点为57.7℃,且遇水易反应,
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(2)装置B中的试剂是饱和食盐水;装置C的作用为干燥氯气
(3)装置D的玻璃管中发生主要反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO,装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响),研究小组实验设计如下
【提出假设】假设1:只有SO32-:假设2:既无SO32-也无ClO-;假设3:只有ClO-:
【设计方案,进行试验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.各取少量吸收液于a、b、c三支试管中,分别滴加3mol/L H2SO4酸化后,进行下列实验:
请完成如表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 则假设2成立 | ||
| ③ | 向c试管中滴加几滴淀粉-KI溶液 | 则假设3成立 |
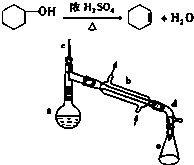 醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如图:
醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如图:可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯l0g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸.
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是吸收水.
(6)本实验所得到的环已烯产率是C(填正确答案标号).
A.41% B.50% C.61% D.70%
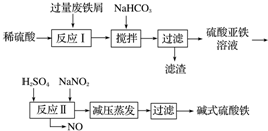
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示.
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH,使溶液中的Al(OH)3沉淀,该工艺中“搅拌”的作用是使反应物充分接触反应.
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
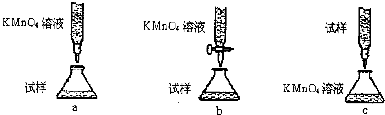
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为D(填字母).
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液.
| A. | -74.8kJ.mol-1 | B. | +74.8kJ.mol-1 | C. | -149.6kJ.mol-1 | D. | +149.6kJ.mol-1 |

 .
.