题目内容
3.向4.0L容器中充入0.70 mol SO2和0.40 mol O2,4s后测得剩余SO2 0.30 mol,则v(O2)为( )| A. | 0.10 mol•L-1•s-1 | B. | 0.025 mol•L-1•s-1 | ||
| C. | 0.50 mol•L-1•s-1 | D. | 0.0125 mol•L-1•s-1 |
分析 由题目中的数据计算v(SO2)=$\frac{0.7mol-0.3mol}{4L×4s}$=0.025mol•L-1•s-1,2SO2(g)+O2(g)?2SO3(g),根据化学反应速率之比等于化学计量数之比计算v(O2).
解答 解:v(SO2)=$\frac{0.7mol-0.3mol}{4L×4s}$=0.025mol•L-1•s-1,
由2SO2(g)+O2(g)?2SO3(g)可知,
v(O2)=$\frac{1}{2}×$v(SO2)=$\frac{1}{2}×$0.025mol•L-1•s-1=0.0125 mol•L-1•s-1,
故选D.
点评 本题考查了化学反应速率的计算,难度不大,注意根据题干中SO2的数据计算v(SO2),然后根据化学反应速率之比等于化学计量数之比计算v(O2).

练习册系列答案
相关题目
13.化学是一门实用性强的自然科学,在社会、生产、生活中起着重要的作用,下列说法正确的是( )
| A. | 金属钾具有强还原性,可用其余TiCl溶液反应制取金属Ti | |
| B. | 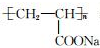 表示一种易溶于水的高分子树脂 表示一种易溶于水的高分子树脂 | |
| C. | 由于Si是一种很重要的半导体材料,故常用其来制作信息的传到材料-光导纤维 | |
| D. | 山东东营广饶县一男子子收到网购物品后,因吸人氟乙酸甲酯中毒身亡,氟乙酸甲酯的结构简式为FCH2COOCH3能与H2发生加成反应.也能被LiAlH4还原 |
14.钐(Sm)属于稀土元素,${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是钐元素的两种同位素.以下说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同素异形体 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm具有相同核外电子排布 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的性质完全相同 | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质子数不同,但中子数相同 |
18.某新研制药品的主要成分结构如下所示.关于其说法不正确的是( )


| A. | 其分子为C8H8O2•H2O | |
| B. | 该物质属于水合物 | |
| C. | 1 mol该物质可与3 mol H2发生加成反应 | |
| D. | 该有机物属于芳香烃类 |
8.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24LCCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6 g铁粉在2.24l(标准状况)氯气中充分燃烧,失去的电子数为0.3NA | |
| D. | 常温常压下,10 g46%酒精水溶液中含氧原子总数为0.1NA |
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向FeSO4溶液中滴入少量酸性KMnO4溶液 | KMnO4溶液紫色褪去 | Fe2+有氧化性 |
| B | 向Na2SiO3溶液中通入适量的CO2 | 产生白色胶状物质 | 酸性:H2CO3>H2SiO3 |
| C | 将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液呈橙红色 | 氧化性:Cl2>Br2 |
| D | 向Al2(SO4)3溶液中滴加过量氨水 | 溶液先浑浊后澄清 | Al3+与NH3•H2O不能大量共存 |
| A. | A | B. | B | C. | C | D. | D |
12.黑火药爆炸时可发生如下反应:4S+16KNO3+16C→3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
| A. | KNO3只发生氧化反应 | B. | 反应消耗12g C时电子转移5mol | ||
| C. | 还原产物只有K2S和 N2 | D. | 被氧化与被还原的S为1:3 |
17.工业上获得大量乙烯、丙烯、丁二烯的方法是( )
| A. | 卤代烃消除 | B. | 煤高温干馏 | C. | 炔烃加成 | D. | 石油裂解 |
 .
.