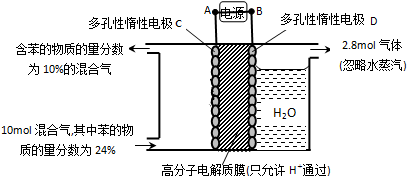
题目内容
11.有机物W的相对分子质量大于110,小于150,其中碳和氢的质量分数之和为51.52%,W在氧气中完全燃烧只生成二氧化碳和水.请回答下列问题:(1)W分子中含有4个氧原子.
(2)W的相对分子质量是132.
(3)W的分子式是C5H8O4.
(4)根据下列信息推断W的结构简式:
①若W在核磁共振氢谱上只有2个峰,能和碳酸氢钠反应放出二氧化碳,则W的结构简式为HOOCC(CH3)2COOH,写出W与足量的乙醇在浓硫酸、加热条件下反应的化学方程式:HOOCC(CH3)2COOH+2CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2OOCC(CH3)2COOCH2CH3+2H2O.
②若W在核磁共振氢谱上两组峰的面积之比为1:1,则W的结构简式为
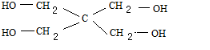 .
.
分析 (1)根据含氧量和相对分子质量的范围,得出氧原子数的范围,最终确定分子中含有的氧原子数目;
(2)根据氧元素的质量分数、分子中含有的氧原子数目求出有机化合物的相对分子质量,利用摩尔质量在以g/mol为单位时在数值上等于相对分子质量,求出该有机化合物的摩尔质量;
(3)根据相对分子质量和分子中含有的氧原子数目计算化学式;
(4)①W在核磁共振氢谱上只有2个峰,说明只具有2种环境不同的H,乙醇与羧酸反应生成酯,据此解答即可;
②若W在核磁共振氢谱上两组峰的面积之比为1:1,故此有机物中的两种H个数相同,据此解答即可.
解答 解:(1)由题意知,氧的质量分数为1-51.52%=48.48%,由有机化合物的相对分子质量大于110,小于150,即分子中氧原子个数为大于$\frac{110×0.4848}{16}$=3.33,小于$\frac{150×0.4848}{16}$=4.5,所以氧原子为4个,故答案为:4;
(2)分子中氧原子为4个,氧的质量分数为48.48%,则有机化合物分子质量=$\frac{4×16}{0.4848}$=132,所以有机化合物的相对分子质量是132,故答案为:132;
(3)分子中氧原子为4个,所以C、H的相对原子质量之和为:132-16×4=68,可确定化学式为C5H8O4;故答案为:C5H8O4;
(4)①W在核磁共振氢谱上只有2个峰,说明只具有2种环境不同的H,能与碳酸氢钠反应放出二氧化碳气体,说明此有机物含有-COOH,且为2个,此时有一种H,故剩余6个H应为1种环境的H,故此有机物的结构简式为:HOOCC(CH3)2COOH,与足量乙醇反应生成酯,化学反应方程式为:HOOCC(CH3)2COOH+2CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2OOCC(CH3)2COOCH2CH3+2H2O,故答案为:HOOCC(CH3)2COOH;HOOCC(CH3)2COOH+2CH3CH2OH$?_{△}^{浓硫酸}$CH3CH2OOCC(CH3)2COOCH2CH3+2H2O;
②若W在核磁共振氢谱上两组峰的面积之比为1:1,故此有机物中的两种H个数相同,即分别为4,结构简式为: ,
,
故答案为: .
.
点评 本题主要考查有机物分子式的确定,题目难度不大,注意计算氧原子数为解答该题的关键.

| A. | 25℃时,pH=11的Na2CO3溶液中水电离出来的H+数目为10-3NA | |
| B. | 78gNa2S和Na2O2的混合物中阴离子的数目为2NA | |
| C. | 在标准状况下,11.2LCCI4分子中氯原子数目为2NA | |
| D. | 室温下,4.4g乙醛和乙酸乙酯的混合物中含有碳原子数目为0.2NA |
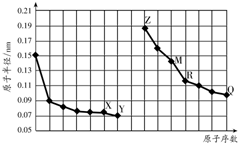
| A. | R在周期表的第15列 | |
| B. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| C. | 简单离子的半径:X>Z>M | |
| D. | Z的单质能从M与Q元素构成的盐溶液中置换出单质M |
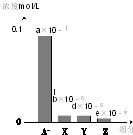 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )| A. | 该溶液pH=7 | B. | 该溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | HA为强酸 | D. | 图中X表示HA,Y表示OH-,Z表示H+ |

| A. | 分子式为C17H18O3 | |
| B. | M中有4个饱和碳原子 | |
| C. | M可以使溴水和酸性高锰酸钾溶液褪色,但它们的反应类型不同 | |
| D. | 1mol M常温下最多可以与6 mol H2反应 |
| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
| A. | 0.10 mol•L-1•s-1 | B. | 0.025 mol•L-1•s-1 | ||
| C. | 0.50 mol•L-1•s-1 | D. | 0.0125 mol•L-1•s-1 |
| A. | 乙二醇和丙三醇是1:1 | B. | 乙醇和乙二醇是1:2 | ||
| C. | 甲醇和乙醇是5:1 | D. | 甲醇和乙醇是4:1 |
 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$ (g)
(g)