题目内容
8.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,2.24LCCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 5.6 g铁粉在2.24l(标准状况)氯气中充分燃烧,失去的电子数为0.3NA | |
| D. | 常温常压下,10 g46%酒精水溶液中含氧原子总数为0.1NA |
分析 A、标况下,四氯化碳为液态;
B、求出白磷的物质的量,然后根据1mol白磷中含6molP-P键来分析;
C、求出铁的物质的量和氯气的物质的量,然后判断两者反应的量的情况;
D、水溶液中水中也含氧原子.
解答 解:A、标况下,四氯化碳为液态,故不能根据气体摩尔体积来计算,故A错误;
B、12.4g白磷分子(分子式为P4)的物质的量是$\frac{12.4g}{124g/mol}$=0.1mol,白磷是正四面体型结构,分子中含有6个P-P共价键,所以0.1mol白磷分子中含有0.6molP-P键,含有P-P共价键数目为0.6NA,故B正确;
C、5.6g铁粉的物质的量为0.1mol,由于与氯气反应后变为+3价,故0.1mol铁粉应消耗0.15mol氯气,而标况下2.24L氯气的物质的量才是0.1mol,故氯气不足,铁粉过量,故应根据氯气的量来计算转移的电子的情况,由于反应后氯元素变为-1价,故0.1mol氯气转移0.2mol电子,故C错误;
D、溶剂水中含有氧原子,10g46%酒精水溶液含氧原子总数大于0.1NA,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
18.下列有关实验操作的解释或纵论正确的是( )
| 选项 | 实验操作 | 解释或结论 |
| A | 向某溶液中滴加盐酸酸化的BaCl2溶液,出现白色沉淀 | 溶液中一定含有SO42- |
| B | 将某气体通入品红溶液中溶液褪色,加热褪色后的溶液,溶液又恢复原色 | 该气体为SO2 |
| C | 用蒸馏水润湿的pH试纸测溶液的pH | 一定会使测定结果偏低 |
| D | 向混有乙酸和乙醇的乙酸乙酯中加入氢氧化钠溶液 | 除溶液中的乙酸和乙醇 |
| A. | A | B. | B | C. | C | D. | D |
19.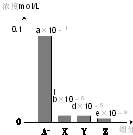 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示(a、b、d、e均为不超过1的正数),则下列说法正确的是( )| A. | 该溶液pH=7 | B. | 该溶液中:c(A-)+c(Y)=c(Na+) | ||
| C. | HA为强酸 | D. | 图中X表示HA,Y表示OH-,Z表示H+ |
16.化学与生活、社会密切相关,下列有关说法中正确的是( )
| A. | “低碳生活”是指生活中尽量使用含碳量较低的物质 | |
| B. | 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排 |
3.向4.0L容器中充入0.70 mol SO2和0.40 mol O2,4s后测得剩余SO2 0.30 mol,则v(O2)为( )
| A. | 0.10 mol•L-1•s-1 | B. | 0.025 mol•L-1•s-1 | ||
| C. | 0.50 mol•L-1•s-1 | D. | 0.0125 mol•L-1•s-1 |
13.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol•L-1Ba(OH)2溶液中含有0.2nA个OH- | |
| B. | 1mol Na与足量水反应,转移2nA个电子 | |
| C. | 常温常压下,22.4L乙烯含有nA个CH2=CH2分子 | |
| D. | 常温常压下,46g NO2含有2nA个氧原子 |
20.两种醇的混合物4.176g与足量金属钠反应得到氢气1.344L(标况状况),该混合物中,两种醇的物质量之比为( )
| A. | 乙二醇和丙三醇是1:1 | B. | 乙醇和乙二醇是1:2 | ||
| C. | 甲醇和乙醇是5:1 | D. | 甲醇和乙醇是4:1 |
1.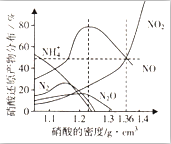 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
2.某课外活动小组的同学从采集器中获得雾霾颗粒样品,然后用蒸馏水溶解,得到可溶性成分的浸取液.在探究该浸取液成分的实验中,下列根据实验现象得出的结论错误的是( )
| A. | 取浸取液少许,滴入AgNO3溶液有白色沉淀产生,则可能含有Cl- | |
| B. | 取浸取液少许,加入Cu和浓H2SO4,试管口有红棕色气体产生,则可能含有NO3- | |
| C. | 取浸取液少许,滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,则一定含SO42- | |
| D. | 用洁净的铂丝棒蘸取浸取液,在酒精灯外焰上灼烧,焰色呈黄色,则一定含有Na+ |