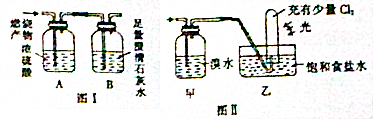
题目内容
6.对于容积固定的反应:N2(g)+3H2(g)?2NH3(g),达到平衡的标志有AB.A.N2、H2、NH3的百分含量不再变化
B.总压强不变
C.N2、H2、NH3的分子数之比为1:3:2
D.N2、H2、NH3的浓度相等
E.N2、H2不再起反应
F.v(N2)=v(H2)
分析 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此根据化学平衡状态的特征进行判断.
解答 解:A、N2、H2、NH3的百分含量不再变化,说明各组分浓度不变,反应达到平衡状态,故A正确;
B、容器体积固定,反应前后气体物质的量不同,压强不变说明各组分浓度不变,反应达到平衡状态,故B正确;
C、各组分的分子数之比,不能判断各组分浓度是否变化,无法判断是否达到了平衡状态,故C错误;
D、各组分浓度大小,与加入多少以及反应程度有关,与平衡状态无关,故D错误;
E、化学平衡状态是正逆反应速率相等且不等于0的状态,故E错误;
F、v(N2)=v(H2),即不符合速率之比等于化学计量数之比也看不出正逆反应速率的关系,无法判断反应是否达到平衡状态,故F错误;
故答案为:AB.
点评 本题考查了化学平衡状态的判断,难度不大,注意反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
17.已知维生素A的结构简式如图,关于它的说法正确的是( )
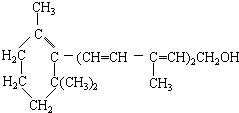
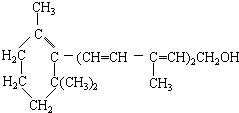
| A. | 维生素A分子含有氢原子数为奇数 | |
| B. | 维生素A的分子中含有苯环结构 | |
| C. | 1mol维生素A在催化剂作用下,可以和5molH2完全加成 | |
| D. | 维生素A属于醇,是一种水溶性维生素,可以发生消去反应 |
14.下列叙述正确的是( )
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4C1至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
18.常温下的4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成
①NH4Cl与NaOH ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NaHCO3
下列各项正确的是( )
①NH4Cl与NaOH ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NaHCO3
下列各项正确的是( )
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
14.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
| A. | 单质的化学活泼性:W<X<Y<Z | B. | 单质的氧化能力:W>X>Y>Z | ||
| C. | 原子最外层电子数:W<X<Y<Z | D. | 元素的最高化合价:W<X<Y<Z |
15.下列电池工作时,O2在正极放电的是( )
| A. |  锌锰电池 | B. |  氢燃料电池 | ||
| C. |  铅蓄电池 | D. |  镍镉电池 |
 .
. (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取