题目内容
6.(1)往铜和稀硫酸的混合物中加入双氧水溶液,可以观察到的实验现象是:溶液变蓝,并产生无色气体,请写出涉及这一现象的所有化学反应方程式:Cu+H2O2+H2SO4=CuSO4+2H2O,2H2O2$\frac{\underline{\;Cu_{2}+\;}}{\;}$2H2O+O2↑.(2)两个氧化还原反应的离子方程式如下:
①R3++Cl2+6OH-=RO3-+2Cl-+3H2O ②5RO3-+2Mn2++14H+=5R3++2MnO4-+7H2O由此不能(填“能”或“不能”)得出Cl2的氧化性比MnO4-强的结论,理由是两个反应是不在相同条件下进行的.
分析 (1)酸性环境下双氧水具有氧化性,能将金属铜氧化,铜离子催化双氧水分解;
(2)物质的氧化性与溶液的酸碱性有关.
解答 解:(1)酸性环境下双氧水具有氧化性,能将金属铜氧化,其反应的方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,反应生成的铜离子能够催化双氧水分解,其反应的方程式为:2H2O2$\frac{\underline{\;Cu_{2}+\;}}{\;}$2H2O+O2↑;
故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;2H2O2$\frac{\underline{\;Cu_{2}+\;}}{\;}$2H2O+O2↑;
(2)物质的氧化性与溶液的酸碱性有关,R3++Cl2+6OH-=RO3-+2Cl-+3H2O 是在碱性条件下发生的,5RO3-+2Mn2++14H+=5R3++2MnO4-+7H2O是在酸性条件下发生的,反应条件不同,不能比较物质的氧化性强弱;
故答案为:不能;两个反应是不在相同条件下进行的.
点评 本题考查了氧化还原反应、方程式的书写、氧化性的比较,题目难度不大,注意把握氧化性比较时反应条件要相同.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.已知维生素A的结构简式如图,关于它的说法正确的是( )
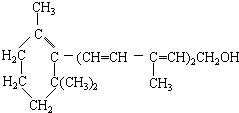
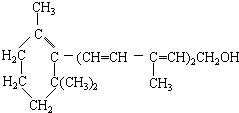
| A. | 维生素A分子含有氢原子数为奇数 | |
| B. | 维生素A的分子中含有苯环结构 | |
| C. | 1mol维生素A在催化剂作用下,可以和5molH2完全加成 | |
| D. | 维生素A属于醇,是一种水溶性维生素,可以发生消去反应 |
18.常温下的4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成
①NH4Cl与NaOH ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NaHCO3
下列各项正确的是( )
①NH4Cl与NaOH ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NaHCO3
下列各项正确的是( )
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
14.同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是( )
| A. | 单质的化学活泼性:W<X<Y<Z | B. | 单质的氧化能力:W>X>Y>Z | ||
| C. | 原子最外层电子数:W<X<Y<Z | D. | 元素的最高化合价:W<X<Y<Z |
1.节日期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
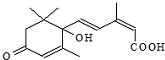

| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 分子中有三种官能团 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
11.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中不正确的是( )
| A. | 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ | |
| B. | 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+3OHˉ=Al(OH)3 | |
| C. | 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-=Fe2+ | |
| D. | 由Fe、Cu、浓硝酸组成的原电池,开始时其负极反应式为:Cu-2e-=Cu2+ |
18.关于硝酸的说法正确的是( )
| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
15.下列电池工作时,O2在正极放电的是( )
| A. |  锌锰电池 | B. |  氢燃料电池 | ||
| C. |  铅蓄电池 | D. |  镍镉电池 |