题目内容
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
B.将水加热,KW增大,pH不变
C.向水中加入氨水,平衡逆向移动,c(OH-)降低
D.向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低
【答案】A
【解析】
A. 硫酸氢钠为强电解质,完全电离,c(H+)增大,水的电离被抑制,但温度不变,因此KW不变,A项正确;
B. 水的电离为吸热的过程,升高温度,促进水的电离,KW增大,水电离出的H+浓度增大,因此pH减小,B项错误;
C. 一水合氨为弱碱,电离出OH-抑制了水的电离,使水的电离平衡逆向移动,但c(OH-)增大,C项错误;
D. 向水中加入固体醋酸钠,CH3COO-与水电离出的H+结合生成弱电解质CH3COOH,使水电离出的H+浓度减小,促进了水的电离,平衡正向移动,D项错误;
答案选A。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】下列实验中,所选用的装置、药品及对应原理都正确的是
选项 | 目的 | 装置 | 原理 |
A | 分离乙酸乙酯和乙醇 |
| 乙酸乙酯和乙醇的密度不同 |
B | 实验室制备氨气 |
|
|
C | 证明非金属性N>C>Si |
| 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
D | 除去丁醇中的乙醚 |
| 丁醇和乙醚的沸点不同 |
A.AB.BC.CD.D
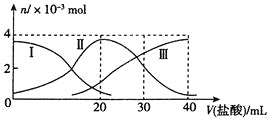
【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为___________________________。
(2)反应开始至2 min,用Y表示的平均反应速率为_________,X的转化率为________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是_______。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是________(填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量