题目内容
【题目】已知:常阻下,Ksp.(ZnS)=1.6×10—24;pM=—lgc(M2+)(MI2+为Cu2+或Zn2+)。常温下,向10 mL 0.10 mol/L CuCl2溶液中滴加0.10 mol/L Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )
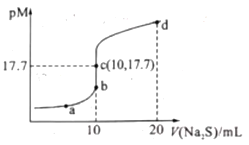
A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl—)>c(S2—)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向b方向移动
【答案】B
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中有关守恒分析解答此题。
A.该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)·c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4=100.6×10-36,由于1<100.6<10,则Ksp(CuS)的数量级为10-36,故A正确;
B.a点溶液中所含有的溶质为NaCl和Na2S,则根据物料守恒可知,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]+c(Cl—),故B错误;
C.d点时溶质为NaCl和Na2S,n(Na+)=0.1mol/L×0.02L×2=0.004mol,n(Cl-)=0.1mol/L×0.01L×2=0.002mol,即c(Na+)>c(Cl-),Na2S是弱酸强碱盐,水解使溶液显碱性,即c(S2-)>c(OH-)>c(H+),所以c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+),故C正确;
D.已知Ksp(CuS)=10-35.4、Ksp(ZnS)=1.6×10—24,则若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,滴加Na2S溶液10mL时恰好完全反应,此时溶液中c(Zn2+)>c(Cu2+),即PM(Cu2+)>PMc(Zn2+),反应终点c向b方向移动,故D正确;
故答案为B。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】有a、b、c、d四个金属电极,G为电流计。有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小、b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电子从d极流向a极 |
由此可判断这四种金属的活动性顺序是
A. d>a>b>cB. a>b>c>dC. b>c>d>aD. a>b>d>c