题目内容
12.下列叙述中,不正确的是( )| A. | 元素金属性:Al<Mg<Na | B. | 元素非金属性:F>Cl>Br | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 气态氢化物稳定性:HF>HCl>H2S |
分析 A、同周期元素的金属性从左到右逐渐减弱;
B、同主族元素的非金属性从上到下逐渐减弱;
C、根据元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强;
D、根据元素的非金属性越强其对应的氢化物越稳定.
解答 解:A、同周期元素的金属性从左到右逐渐减弱,所以元素金属性:Al<Mg<Na,故A正确;
B、同主族元素的非金属性从上到下逐渐减弱,所以非金属性:F>Cl>Br,故B正确;
C、根据元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S>P,所以酸性:HClO4>H2SO4>H3PO4,故C错误;
D、根据元素的非金属性越强其对应的氢化物越稳定,非金属性:F>Cl>S,所以稳定性:HF>HCl>H2S,故D正确;
故选C.
点评 本题考查学生元素周期律的应用知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
3.下列叙述正确的是( )
| A. | 向BaCl2溶液中通入SO2气体,先有白色沉淀,后沉淀消失 | |
| B. | CCl4和NH3两分子中各原子最外层均满足8电子结构 | |
| C. | 若短周期元素R2+和M+的电子层结构相同,则金属性R>M | |
| D. | 标准状况下,11.2 LN2和O2的混合气所含原子总数约为6.02×1023 |
20.下列化学用语表示正确的是( )
| A. | 钾原子结构示意图: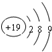 | B. | CCl4的电子式: | ||
| C. | HClO的结构式:H-Cl-O | D. | MgCl2的电子式: |
17.下表是元素周期表的一部分,请回答有关问题:
(1)这10种元素分别为:①O②F③Na④Mg⑤P⑥S⑦Cl⑧Ar⑨K⑩Br(用元素符号表示);
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为K>Na>Mg,这三种元素的最高价氧化物的水化物中,按碱性由强到弱顺序排列为KOH>NaOH>Mg(OH)2(用化学式表示);
(3)①对应元素名称为氧,在元素周期表中所处位置为第二周期ⅥA族其氢化物与③反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(4)⑤、⑥、⑦三种元素的最高价氧化物的水化物酸性由强到弱顺序排列为HClO4>H2SO4>H3PO4;②、⑦、⑩氢化物稳定性由强到弱顺序排列为HF>HCl>HBr(用化学式表示);
(5)③元素与⑦元素两者核电荷数之差是6.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为K>Na>Mg,这三种元素的最高价氧化物的水化物中,按碱性由强到弱顺序排列为KOH>NaOH>Mg(OH)2(用化学式表示);
(3)①对应元素名称为氧,在元素周期表中所处位置为第二周期ⅥA族其氢化物与③反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(4)⑤、⑥、⑦三种元素的最高价氧化物的水化物酸性由强到弱顺序排列为HClO4>H2SO4>H3PO4;②、⑦、⑩氢化物稳定性由强到弱顺序排列为HF>HCl>HBr(用化学式表示);
(5)③元素与⑦元素两者核电荷数之差是6.
4.下列试剂,必须用棕色瓶盛装的是( )
①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银.
①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银.
| A. | ①②③④⑤⑥ | B. | ②③④⑥ | C. | ②③⑤⑥ | D. | ①③④⑥ |
1.下列有关卤族元素的叙述不正确的是( )
| A. | 卤族元素从F到I,其气态氢化物的稳定性逐渐减弱,HX水溶液酸性逐渐增强 | |
| B. | 卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 | |
| C. | 卤族元素从F到I,HX的熔沸点:HF>HI>HBr>HCl | |
| D. | 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来 |
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题: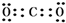 .
. ;
;