题目内容
2. A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大,B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零,D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$-n,请回答下列问题:(1)D元素在周期表中的位置是第二周期VIA族;
(2)写出一个E和D形成的化合物与水反应的离子方程式Na2O+H2O=2Na++2OH?或2Na2O2+2H2O=4Na++4OH?+O2↑;
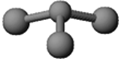
(3)已知:甲+H2O→丙+丁.若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性.则甲中Cl元素的化合价是+1,丁与H2O有相同的电子总数,则丁的化学式为NH3.
(4)E2D和CA3沸点差距极大,其原因是Na2O为离子晶体,NH3而是分子晶体
(5)写出单质B与过量单质D在高温下完全反应后都生成物的电子式
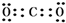 .
.
分析 (1)(2)A、B、C、D、E五种短周期元素,它们的原子序数依次增大.B原子的最外层电子数是其次外层电子数的2倍,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;A的一种原子中质量数与质子数之差为零,即没有中子,则A为氢元素;D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$,则m+n=8,故D原子有2个电子层,即n=2,则m=8-2=6,故D为氧元素,C的原子序数介于B、D之间,所以C为N,E的M层电子数=$\frac{6}{2}$-2=1,故E为Na;
(3)中若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,根据其模型知,大球是氯原子,小球是N元素,所以该物质是NCl3,丙具有漂白性,根据元素守恒知,丙是次氯酸,丁与H2O有相同的电子总数,结合原子守恒知,丁是氨气;
(4)不同类型的晶体的沸点不一样,离子晶体的沸点远远高于分子晶体;
(5)B与D在高温下完全反应后生成物为二氧化碳,二氧化碳分子中C原子与O原子之间形成2对共用电子对.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.B原子的最外层电子数是其次外层电子数的2倍,B原子只能有2个电子层,最外层电子数为4,则B为碳元素;A的一种原子中质量数与质子数之差为零,即没有中子,则A为氢元素;D元素的原子最外层电子数为m,次外层电子数为n,E元素的原子L层电子数为m+n,M层电子数为$\frac{m}{2}$,则m+n=8,故D原子有2个电子层,即n=2,则m=8-2=6,故D为氧元素,C的原子序数介于B、D之间,所以C为N,E的M层电子数=$\frac{6}{2}$-2=1,故E为Na,
(1)D为氧元素,处于周期表中第二周期VIA族,
故答案为:第二周期VIA族;
(2)E和D形成的化合物为氧化钠或过氧化钠,与水反应的离子方程式为:Na2O+H2O=2Na++2OH?或2Na2O2+2H2O=4Na++4OH?+O2↑,
故答案为:Na2O+H2O=2Na++2OH?或2Na2O2+2H2O=4Na++4OH?+O2↑;
(3)若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,根据其模型知,大球是氯原子,小球是N元素,所以该物质是NCl3,丙具有漂白性,根据元素守恒知,丙是次氯酸,因为该反应是非氧化还原反应,所以Cl元素的化合价不变,所以甲中氯元素的化合价是+1价,丁与H2O有相同的电子总数,结合原子守恒知,丁是NH3,
故答案为:+1;NH3;
(4)E2D为Na2O、CA3为NH3,Na2O为离子晶体,NH3而是分子晶体,所以Na2O的沸点远远高于NH3的沸点,
故答案为:Na2O为离子晶体,NH3而是分子晶体;
(5)B与D在高温下完全反应后生成物为二氧化碳,二氧化碳分子中C原子与O原子之间形成2对共用电子对,电子式为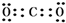 ,
,
故答案为: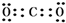 .
.
点评 本题考查结构性质位置关系应用,侧重对常用化学用语的考查,(3)中注意根据分子结构及生成物的性质推断,难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | NaHSO3(s)═Na2SO3(s)+H2O (g)+SO2(g) | B. | N2O3 (l)═NO2(g)+NO(g) | ||
| C. | MgCO3(s)═MgO(s)+CO2(g) | D. | 2CO(g)═2C(s)+O2(g) |
①淀粉、纤维素、油脂、蛋白质都是天然有机高分子化合物
②淀粉、纤维素、蔗糖都是非还原性糖
③三大营养素糖类、油脂、蛋白质中,油脂是热能最高的营养素
④用纯碱(Na2CO3)热溶液洗涤餐具上的油污
⑤氯水使红墨水褪色原理和CH2=CH2使Br2的CCl4溶液褪色原理相同
⑥现用清洁燃料主要有压缩天然气和液化石油气两类,它们均属于碳氢化合物.
| A. | ①②③ | B. | ②③④⑥ | C. | ②④⑤⑥ | D. | ③④⑤ |
 如图是一种锂离子电池充、放电的工作示意图.放电时该电池的正、负极反应式分别为负极:Li-e-═Li+;正极:Li4Ti5O12+3Li++3e-═Li7Ti5O12.下列说法正确的是( )
如图是一种锂离子电池充、放电的工作示意图.放电时该电池的正、负极反应式分别为负极:Li-e-═Li+;正极:Li4Ti5O12+3Li++3e-═Li7Ti5O12.下列说法正确的是( )| A. | K与N相接时,Li+由A极区迁移到B极区 | |
| B. | 在整个充、放电过程至少存在3种形式的能量转化 | |
| C. | K与M相接时,A是阳极,发生氧化反应 | |
| D. | 放电时当转移1mol电子时应该有0.5mol Li+从右槽迁移进左槽 |
| A. | 有化学键破坏的变化不一定属于化学变化 | |
| B. | 发生了颜色变化的一定是化学变化 | |
| C. | 有单质参加和生成的变化一定是氧化还原反应 | |
| D. | 爆炸一定是化学变化 |
| A. | Ca2+数目减少 | B. | Ca2+浓度增大 | ||
| C. | 溶液的pH增大 | D. | Ca(OH)2固体质量不变 |
| A. | 元素金属性:Al<Mg<Na | B. | 元素非金属性:F>Cl>Br | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 气态氢化物稳定性:HF>HCl>H2S |

