题目内容
17.下表是元素周期表的一部分,请回答有关问题:主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)③、④、⑨三种元素按原子半径由大到小的顺序排列为K>Na>Mg,这三种元素的最高价氧化物的水化物中,按碱性由强到弱顺序排列为KOH>NaOH>Mg(OH)2(用化学式表示);
(3)①对应元素名称为氧,在元素周期表中所处位置为第二周期ⅥA族其氢化物与③反应的化学方程式为2Na+2H2O=2NaOH+H2↑;
(4)⑤、⑥、⑦三种元素的最高价氧化物的水化物酸性由强到弱顺序排列为HClO4>H2SO4>H3PO4;②、⑦、⑩氢化物稳定性由强到弱顺序排列为HF>HCl>HBr(用化学式表示);
(5)③元素与⑦元素两者核电荷数之差是6.
分析 (1)由元素在周期表中的位置可知,①为O,②为F,③为Na,④为Mg,⑤为P,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;同周期从左向右元素的金属性减弱,同主族从上到下元素的金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)由元素在周期表中位置,可知①为氧元素,处于第二周期ⅥA族;钠与水反应生成氢氧化钠与氢气;
(4)同周期从左向右元素非金属性增强,同主族自上而下非金属性减弱,非金属性越强,元素的最高价氧化物对应水化物的酸性越强、氢化物越稳定;
(5)③⑦处于第三周期,核电荷数之差等于族序数之差.
解答 解:(1)由元素在周期表中的位置可知,①为O,②为F,③为Na,④为Mg,⑤为P,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
故答案为:O;F;Na;Mg;P;S;Cl;Ar;K;Br;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:K>Na>Mg;同周期从左向右元素的金属性减弱,同主族从上到下元素的金属性增强,金属性K>Na>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:KOH>NaOH>Mg(OH)2,
故答案为:K>Na>Mg;KOH>NaOH>Mg(OH)2;
(3)由元素在周期表中位置,可知①为氧元素,处于第二周期ⅥA族;钠与水反应生成氢氧化钠与氢气,反应方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:氧;第二周期ⅥA族;2Na+2H2O=2NaOH+H2↑;
(4)同周期从左向右元素非金属性增强,故非金属性Cl>S>P,故酸性:HClO4>H2SO4>H3PO4,
同主族自上而下非金属性减弱,故非金属性F>Cl>Br,故氢化物稳定性:HF>HCl>HBr,
故答案为:HClO4>H2SO4>H3PO4;HF>HCl>HBr;
(5)③⑦处于第三周期,核电荷数之差等于族序数之差,即二者核电荷数相差7-1=6,故答案为:6.
点评 本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置是解答本题的关键,并利用元素周期律来解答即可,难度不大.

| A. | 有化学键破坏的变化不一定属于化学变化 | |
| B. | 发生了颜色变化的一定是化学变化 | |
| C. | 有单质参加和生成的变化一定是氧化还原反应 | |
| D. | 爆炸一定是化学变化 |
| A. | 元素金属性:Al<Mg<Na | B. | 元素非金属性:F>Cl>Br | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 气态氢化物稳定性:HF>HCl>H2S |
| A. | Fe2O3 | B. | FeS | C. | Cu(OH)2 | D. | C |
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
(1)写出四种元素的元素名称:X镁 Y铝 Z氮 W氧
(2)写出实验室制取Z的气态氢化物的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+CaCl2+2H2O,常用向下排空气法(方法)来收集Z的气态氢化物.
(3)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+3H+=Al3++3H2O
(4)一定条件下,W单质可以将Z单质从其氢化物中置换出来,请写出其化学反应方程式:4NH3+3O2 $\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
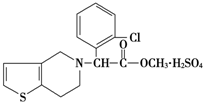 波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )
波立维是国家刚刚引进的新药,它给中风、心肌梗死等心脏病患者带来福音,波立维属于硫酸氢盐,它的结构如图所示,下列关于它的说法正确的是( )| A. | 该物质的化学式为C16H15ClNO2•H2SO4 | |
| B. | 该物质难溶于水 | |
| C. | 波立维能形成硫酸氢盐是与其结构中的氮原子有关 | |
| D. | 它可以与NaOH溶液反应,1 mol该物质最多可消耗2mol NaOH |
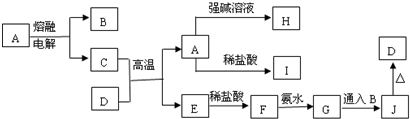
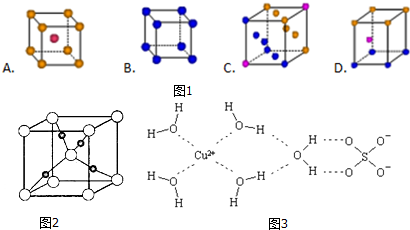
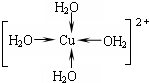 .
. ,A的结构式为
,A的结构式为 ,A分子的空间构型是三角锥形.
,A分子的空间构型是三角锥形.