题目内容
7.(1)请完成下列各空:①pH=a的CH3COOH溶液稀释100倍后所得溶液pH<a+2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH>2(填“>”或“<”);
(2)观察比较以上两个小题,试猜想证明某酸(HA)是弱电解质的原理有两个:
一是:溶液中存在电离平衡;
二是:证明HA不能完全电离.
(3)请你根据以上原理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
①对比等物质的量浓度的HA溶液和盐酸导电性对比实验;
②测0.01mol/LHA溶液的pH>2(或③测pH=a的HA稀释100倍后所得溶液pH<a+2、④中和10mLpH=1的HA溶液消耗pH=13的NaOH溶液的体积大于10mL)..
分析 (1)①CH3COOH是弱酸,存在电离平衡,加水促进电离;
②CH3COOH是弱酸,在水溶液中部分电离,溶液氢离子浓度小于0.01mol/L;
(2)证明HA为弱电解质,可以通过溶液中存在电离平衡或在溶液中部分电离完成;
(3)证明某酸(HA)是弱电解质,可以通过导电性强弱、测定一定浓度时溶液的pH、测定稀释后溶液的pH变化等方法完成.
解答 解:(1)①CH3COOH是弱酸,存在电离平衡,加水促进电离,所以CH3COOH溶液稀释100倍后,pH变化小于2个单位,即所得溶液pH<a+2,故答案为:<;
②CH3COOH是弱酸,在水溶液中部分电离,溶液中氢离子浓度小于0.01mol/L,所以0.01mol/L CH3COOH溶液的pH>2,
故答案为:>;
(2)弱电解质在水溶液里存在电离平衡,证明某酸(HA)属于弱电解质,可证明溶液中存在电离平衡,或证明HA不能完全电离,
故答案为:溶液中存在电离平衡;证明HA不能完全电离;
(3)证明某酸(HA)是弱电解质的方法有)①对比等物质的量浓度的HA溶液和盐酸导电性对比实验;②测0.01mol/LHA溶液的pH>2;③测pH=a的HA稀释100倍后所得溶液pH<a+2;④中和10mLpH=1的HA溶液消耗pH=13的NaOH溶液的体积大于10mL,
故答案为:①对比等物质的量浓度的HA溶液和盐酸导电性对比实验;②测0.01mol/LHA溶液的pH>2(或③测pH=a的HA稀释100倍后所得溶液pH<a+2、④中和10mLpH=1的HA溶液消耗pH=13的NaOH溶液的体积大于10mL).
点评 本题考查了有关弱电解质的电离知识的综合应用,题目难度中等,明确影响弱电解质的电离平衡的因素为解答关键,注意掌握判断弱电解质常用方法.

练习册系列答案
相关题目
2.下列各组酸中,酸性依次增强的是( )
| A. | H2CO3 H2SiO3 H3PO4 | B. | HNO3 H3PO4 H2SO4 | ||
| C. | HI HCl H2S | D. | HClO HClO3 HClO4 |
12.下列叙述中,不正确的是( )
| A. | 元素金属性:Al<Mg<Na | B. | 元素非金属性:F>Cl>Br | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 气态氢化物稳定性:HF>HCl>H2S |
19.下列递变规律不正确的是( )
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | F、Cl、Br氢化物的沸点依次升高 | D. | P、S、Cl最高正价依次升高 |
17.下面三种方法都可以制得氯气.
①MnO2+4HCl(浓)═MnCl2+Cl2+2H2O
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
③4HCl(浓)+O2$\frac{\underline{催化剂}}{△}$2H2O+Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
①MnO2+4HCl(浓)═MnCl2+Cl2+2H2O
②2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2+8H2O
③4HCl(浓)+O2$\frac{\underline{催化剂}}{△}$2H2O+Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
| A. | O2>MnO2>KMnO4 | B. | KMnO4>MnO2>O2 | C. | MnO2>KMnO4>O2 | D. | O2>MnO2>KMnO4 |

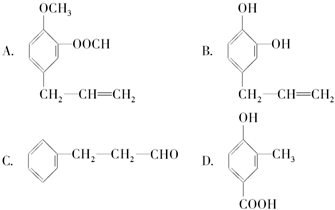
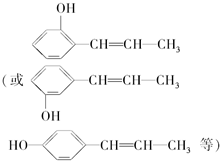 ,
,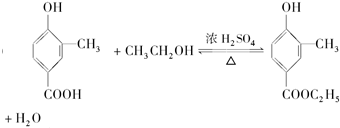 .
.
 ;
;


