题目内容
18.乙醇分子中不同的化学键如图所示,下列不同反应中键的断裂不正确的是( )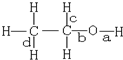
| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和氢溴酸反应键a断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和浓硫酸共热至170℃时键b和d断裂 |
分析 A、乙醇与酸发生酯化反应,断开的羟基上的氢氧键;
B、乙醇与与氢溴酸反应生成溴乙烷和水,断开的碳氧键;
C、乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
D、乙醇和浓硫酸共热时发生消去反应,断裂碳氧键、与羟基所连的碳的相邻的碳上的碳氢键.
解答 解:A、乙醇与酸发生酯化反应,断开左羟基上左氢氧键,即a断裂,故A正确;
B、乙醇与与氢溴酸反应生成溴乙烷和水,断开的碳氧键即图中b断裂,故B错误;
C、乙醇在铜催化下与O2反应生成乙醛和水,断开羟基上氢氧键和与羟基所连碳氢键,即ac断裂,故C正确;
D、乙醇和浓硫酸共热时发生消去反应,断裂碳氧键、与羟基所连相邻碳上碳氢键,即图中bd断裂,故D正确,故选B.
点评 本题主要考查了乙醇的化学性质,掌握反应机理是解本题关键,题目难度不大,注意在浓硫酸作催化剂、170℃下发生消去反应.

练习册系列答案
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
19.通过复习总结,你认为下列对化学知识概括合理的组合是( )
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④过氧化氢和液氮的分子中都有非极性共价键
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑥在熔化状态和水溶液中均不能导电的物质称为非电解质.
①能与酸反应的氧化物,一定是碱性氧化物
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
④过氧化氢和液氮的分子中都有非极性共价键
⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大
⑥在熔化状态和水溶液中均不能导电的物质称为非电解质.
| A. | 只有①②⑥ | B. | 只有③⑥ | C. | 只有③④ | D. | 只有⑤⑥ |
9.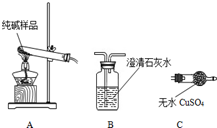 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
(2)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液.将反应混和物过滤、洗涤(填操作)、干燥、称量为m2g.该纯碱样品的纯度为$\frac{106{m}_{2}}{{m}_{1}}$%.
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去.为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
但当温度恢复到10℃,测得溶液pH=9.8.
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-.这两个平衡以水解平衡为主.
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是NaHCO3分解生成Na2CO3,碱性增强(答一条).
 某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:
某实验小组模拟“侯氏制碱法”制纯碱,并进行以下探究:(1)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
| 选择的装置 (填编号) | 实验现象 | 实验结论 |
| AB或AC或ACB | B变浑浊或C变蓝或C变蓝、B变浑 | 样品含 NaHCO3 |
(3)该小组同学在0.1mol/LNaHCO3溶液中滴加酚酞溶液1滴,溶液没有什么变化,但加热后显淡红色,加热较长时间后冷却,红色不褪去.为探究原因,进行了下列实验:
实验1:加热0.1mol/LNaHCO3溶液,测得溶液pH变化如下表
| 温度(℃) | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
实验2:加热0.1mol/LNaHCO3溶液,将产生的气体通入澄清石灰水,澄清石灰水变浑浊.
①用离子方程式表示0.1mol/LNaHCO3溶液中存在的平衡(除水电离平衡外)HCO3-?H++CO32-、HCO3-+H2O?H2CO3+OH-.这两个平衡以水解平衡为主.
②结合实验1、2分析,加热0.1mol/LNaHCO3溶液,pH增大的原因可能是NaHCO3分解生成Na2CO3,碱性增强(答一条).
13.已知汽车尾气无害化处理反应为:2NO(g)+2CO(g)═N2(g)+2CO2(g),下列说法不正确的是( )
| A. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 | |
| B. | 使用高效催化剂可有效提高正反应速率 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 升高温度可使该反应的逆反应速率降低 |
3.下列有关金属的说法中,不正确的是( )
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝是活泼金属,但在空气中耐腐蚀 | |
| C. | MgO可以与Al组成铝热剂,进行铝热反应 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
10.关于化学键的叙述中,正确的是( )
| A. | 单质、共价化合物、离子化合物中都存在共价键 | |
| B. | 金属和非金属所形成的化学键均为离子键 | |
| C. | 阴、阳离子通过静电引力而形成的化学键叫做离子键 | |
| D. | 共价化合物中一定不含离子键 |
7.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | NA个氢氧化铁胶粒的质量为107g | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 在50g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 在密闭容器中,0.5molH2和0.5molN2充分反应后得不到NA个NH3分子 |
8.下列物质中,所含化学键类型完全相同的是( )
| A. | CaCl2 K2S | B. | CO2 Na2O2 | C. | NaOH HCl | D. | NH4Cl CaH2 |